Hvilket grundstof ville du forvente at opfører sig mest som kulstof (C)?
Kulstof og silicium tilhører samme gruppe (gruppe 14) i det periodiske system, også kendt som kulstoffamilien eller tetrels. Grundstoffer inden for samme gruppe deler lignende kemiske egenskaber på grund af tilstedeværelsen af det samme antal valenselektroner (yderste elektroner). Kulstof har fire valenselektroner, som giver det evnen til at danne kovalente bindinger med andre atomer, hvilket gør det muligt for det at danne forskellige og komplekse molekyler.
Silicium har på den anden side også fire valenselektroner som kulstof. Denne lignende elektroniske konfiguration resulterer i mange ligheder i deres kemiske adfærd. Både kulstof og silicium kan danne kovalente bindinger med andre atomer og skabe omfattende netværk. For eksempel danner kulstof rygraden i organiske molekyler, der findes i levende organismer, mens silicium danner grundlaget for mange uorganiske materialer som keramik og halvledere.
Selvom kulstof og silicium deler disse ligheder, er der også forskelle mellem dem på grund af deres positioner i det periodiske system. Silicium er placeret under kulstof og er større i størrelse, hvilket fører til forskelle i elektronegativitet, reaktivitet og bindingsstyrker. Disse forskelle har dog en tendens til at være gradvise, og generelt fungerer silicium som den nærmeste erstatning eller analog til kulstof i forskellige kemiske sammenhænge.
 Varme artikler
Varme artikler
-
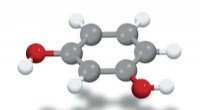 Selektiv syntese af meta-isomerer nu muligFigur 1:En molekylær model af 1,3-dihydroxybenzen (grå kugler:carbonatomer; røde kugler:oxygenatomer; hvide kugler:hydrogenatomer), meta-isomeren af dihydroxybenzen. Et team på RIKEN har udviklet en
Selektiv syntese af meta-isomerer nu muligFigur 1:En molekylær model af 1,3-dihydroxybenzen (grå kugler:carbonatomer; røde kugler:oxygenatomer; hvide kugler:hydrogenatomer), meta-isomeren af dihydroxybenzen. Et team på RIKEN har udviklet en -
 Udskrivning af trådløst genopladelige solid-state superkapacitorer til bløde, smarte kontaktlinse…DIW-baseret fremstilling og karakterisering af MIS-superkapacitoren. (A) Skematisk af den smarte kontaktlinse og DIW-baserede fremstillingsproces af den monolitisk integrerede MIS-superkapacitor med e
Udskrivning af trådløst genopladelige solid-state superkapacitorer til bløde, smarte kontaktlinse…DIW-baseret fremstilling og karakterisering af MIS-superkapacitoren. (A) Skematisk af den smarte kontaktlinse og DIW-baserede fremstillingsproces af den monolitisk integrerede MIS-superkapacitor med e -
 Forskere foreslår en ny teknologi til at skabe magnetmikrostrukturerKonfigurationen af en tynd krystalfilm. Kredit:Anton Tarasov Et team af videnskabsmænd fra Krasnoyarsk Scientific Center (Siberian Department of Russian Academy of Sciences) og Siberian Federal
Forskere foreslår en ny teknologi til at skabe magnetmikrostrukturerKonfigurationen af en tynd krystalfilm. Kredit:Anton Tarasov Et team af videnskabsmænd fra Krasnoyarsk Scientific Center (Siberian Department of Russian Academy of Sciences) og Siberian Federal -
 Organiske solceller, der holder 10 år i rummetKredit:Skoltech 6, 000 Gy, vækker håb om deres stabile drift i kredsløb nær jorden over 10 år eller endnu længere. Resultaterne af undersøgelsen blev offentliggjort i ACS anvendte materialer og g
Organiske solceller, der holder 10 år i rummetKredit:Skoltech 6, 000 Gy, vækker håb om deres stabile drift i kredsløb nær jorden over 10 år eller endnu længere. Resultaterne af undersøgelsen blev offentliggjort i ACS anvendte materialer og g
- Japan, hjemsted for den højteknologiske loo, håber grundlæggende toilet kan redde liv
- Forskere opdager en stærk sammenhæng mellem partiskhed og social mobilitet under COVID-19-pandemie…
- Nye nanotrådstransistorer kan hjælpe med at holde Moores lov i live
- Virusviden låst op af nye metagenomiske teknologier
- Biokompatible fotoniske krystaller udvider applikationer fra optik til medicin
- Hvilke matematikbegreber er nødvendige for at forstå fysikklasser på college niveau?


