Hvilket grundstof ville du forvente opfører sig mest som kulstof?
Her er nogle ligheder mellem kulstof og silicium, der bidrager til deres analoge adfærd:
Atomstruktur:Kulstof og silicium har lignende atomstrukturer med fire elektroner i deres yderste skal. Dette elektroniske arrangement giver dem en tendens til at danne fire kovalente bindinger med andre atomer.
Kovalent binding:Både kulstof og silicium danner primært kovalente bindinger, hvor elektroner deles mellem atomer for at opnå en stabil elektronkonfiguration. Denne evne til at danne stærke kovalente bindinger er grundlaget for deres forskelligartede kemi.
Tetraedrisk binding:Kulstof og silicium vedtager typisk en tetraedrisk molekylær geometri, hvilket betyder, at de danner fire bindinger rettet mod hjørnerne af et tetraeder. Dette tetraedriske arrangement resulterer i dannelsen af forskellige organiske og uorganiske molekyler.
Katenering:Kulstof og silicium udviser den bemærkelsesværdige egenskab ved katenering, som er evnen til at danne stabile kæder eller netværk af atomer ved at binde sig til sig selv. Denne egenskab er ansvarlig for den store mangfoldighed af kulstofbaserede organiske forbindelser og eksistensen af siliciumbaserede materialer såsom silikoner.
Halvledende egenskaber:Kulstof og silicium er begge i stand til at udvise halvledende egenskaber, hvilket betyder, at deres elektriske ledningsevne falder mellem en leders og en isolator. Denne egenskab er afgørende i elektronikindustrien, hvor silicium i vid udstrækning anvendes i transistorer, integrerede kredsløb og solceller.
På trods af disse ligheder har kulstof og silicium også nogle bemærkelsesværdige forskelle. For eksempel er kulstof mere elektronegativt end silicium, hvilket fører til variationer i deres kemiske reaktivitet. Derudover danner kulstof mere forskelligartede og komplekse forbindelser sammenlignet med silicium på grund af dets mindre størrelse og stærkere bindingsenergier.
Sammenfattende er silicium det grundstof, der ligner kulstof mest i dets adfærd og egenskaber. Deres ligheder i atomstruktur, kovalent binding, tetraedrisk geometri, katenation og halvledende egenskaber gør dem til væsentlige elementer inden for forskellige videnskabelige og teknologiske områder.
 Varme artikler
Varme artikler
-
 Forskere afdækker mekanismen for svampeluminescens og skaber selvlysende gærSelvlysende gær. Kredit:Sergey Shakhov Russiske forskere med kolleger fra Storbritannien, Spanien, Brasilien, Japan og Østrig har fuldt ud beskrevet mekanismen for svampeluminescens. De rapportere
Forskere afdækker mekanismen for svampeluminescens og skaber selvlysende gærSelvlysende gær. Kredit:Sergey Shakhov Russiske forskere med kolleger fra Storbritannien, Spanien, Brasilien, Japan og Østrig har fuldt ud beskrevet mekanismen for svampeluminescens. De rapportere -
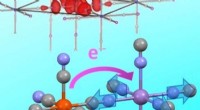 Ultrahurtig ladningsoverførsel i preussisk blå analogerKredit:Wiley Fotoinducerede ladningsoverførsler er en interessant elektronisk egenskab ved preussisk blå og nogle analogt strukturerede forbindelser. Et team af forskere har nu været i stand til a
Ultrahurtig ladningsoverførsel i preussisk blå analogerKredit:Wiley Fotoinducerede ladningsoverførsler er en interessant elektronisk egenskab ved preussisk blå og nogle analogt strukturerede forbindelser. Et team af forskere har nu været i stand til a -
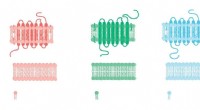 Formskiftende receptorer kan forklare mystiske lægemiddelfejlKredit:CC0 Public Domain For at sukker smager sødt og for at kaffe er stimulerende, eller endda for lys at blive set, først skal de alle lande på en G-proteinkoblet receptor. Allestedsnærværende o
Formskiftende receptorer kan forklare mystiske lægemiddelfejlKredit:CC0 Public Domain For at sukker smager sødt og for at kaffe er stimulerende, eller endda for lys at blive set, først skal de alle lande på en G-proteinkoblet receptor. Allestedsnærværende o -
 Uran afslører sin sande naturKredit:EPFL/EML De fleste mennesker kender til uran som brændstof til atomkraftværker. Og selvom det er den mest almindelige applikation, dette element bruges også på mange andre områder, såsom fa
Uran afslører sin sande naturKredit:EPFL/EML De fleste mennesker kender til uran som brændstof til atomkraftværker. Og selvom det er den mest almindelige applikation, dette element bruges også på mange andre områder, såsom fa
- Ændres lydens hastighed med medium?
- Ledende biopolymerer ved hjælp af genanvendte fødevareindustriens biprodukter
- En 3-punkts plan for at nå netto-nul-emissioner i 2050
- Plasmonisk pincet:Til optisk fangst i nanoskala og mere
- Ingeniører viser, hvordan wolframoxid kan bruges som katalysator i bæredygtige kemiske omdannelser
- Sådan fungerer satellitter


