Hvad sker der, når man blander sukker og vand?
Opløsning :Sukker er et polært kovalent molekyle, hvilket betyder, at det indeholder både polære (ladede) og ikke-polære (uladede) områder. Vand er også et polært molekyle. Når sukker tilsættes vand, omgiver og opløser vandmolekylerne sukkermolekylerne, bryder de intermolekylære bindinger mellem sukkermolekylerne og får dem til at spredes i vandet. Denne proces er kendt som opløsning.
Hydrogenbinding :Sukker- og vandmolekyler kan danne brintbindinger med hinanden. Hydrogenbindinger er intermolekylære kræfter, der opstår, når et brintatom kovalent bundet til et meget elektronegativt atom (såsom oxygen eller nitrogen) tiltrækkes af et andet meget elektronegativt atom. Disse hydrogenbindinger bidrager til sukker-vand-blandingens stabilitet og hjælper med at holde sukkeret opløst i vandet.
Øget tæthed :Tilsætning af sukker til vand øger opløsningens densitet. Dette skyldes, at sukkermolekyler er tættere end vandmolekyler. Som følge heraf øges blandingens samlede tæthed, når sukkerkoncentrationen stiger.
Forhøjet kogepunkt :Kogepunktet for en væske er den temperatur, hvor dens damptryk er lig med det atmosfæriske tryk. Når sukker tilsættes vand, stiger opløsningens kogepunkt. Det skyldes, at de opløste sukkermolekyler forstyrrer vandmolekylernes evne til at undslippe væsken, så der skal mere energi til for at nå kogepunktet.
Koligative egenskaber :Tilsætning af sukker til vand påvirker også opløsningens kolligative egenskaber, som afhænger af koncentrationen af opløste partikler frem for deres kemiske natur. Disse kolligative egenskaber omfatter:
- Damptrykssænkning :Damptrykket af en opløsning er lavere end damptrykket af det rene opløsningsmiddel. Tilsætning af sukker til vand sænker vandets damptryk, fordi sukkermolekylerne konkurrerer med vandmolekyler om plads ved væskens overflade.
- Osmotisk tryk :Osmotisk tryk er det tryk, der skal påføres en opløsning for at forhindre passage af opløsningsmiddel (vand) ind i opløsningen gennem en semipermeabel membran. Tilsætning af sukker til vand øger opløsningens osmotiske tryk, fordi sukkermolekylerne skaber en osmotisk gradient, der trækker vandmolekyler ind i opløsningen.
- Frysepunktssænkning :Frysepunktet for en væske er den temperatur, hvorved den størkner. Tilsætning af sukker til vand sænker opløsningens frysepunkt, fordi de opløste sukkermolekyler forstyrrer dannelsen af iskrystaller.
 Varme artikler
Varme artikler
-
 Kaktusrødder inspirerer til skabelse af vandfastholdende materialeKredit:American Chemical Society Under sjældne ørkenregn, kaktusser spilder ingen tid med at suge op og gemme en storms dyrebare nedbør. Inspireret af dette naturfænomen, videnskabsmænd rapportere
Kaktusrødder inspirerer til skabelse af vandfastholdende materialeKredit:American Chemical Society Under sjældne ørkenregn, kaktusser spilder ingen tid med at suge op og gemme en storms dyrebare nedbør. Inspireret af dette naturfænomen, videnskabsmænd rapportere -
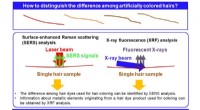 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
 Ny membranteknologi til at øge vandrensning og energilagringEt redox -strømbatteri, der kan skaleres op til energilagring i netskala. Kredit:Qilei Song, Imperial College London Imperial College London forskere har skabt en ny type membran, der kan forbedre
Ny membranteknologi til at øge vandrensning og energilagringEt redox -strømbatteri, der kan skaleres op til energilagring i netskala. Kredit:Qilei Song, Imperial College London Imperial College London forskere har skabt en ny type membran, der kan forbedre -
 Biomimetisk kemi - DNA-mimiker overliste viralt enzymRepræsentationer af en B-DNA dobbelt helix og en enkelt spiralformet foldamer efterligner. Kredit:Ivan Huc, LMU Ikke alene kan syntetiske molekyler efterligne strukturerne i deres biologiske model
Biomimetisk kemi - DNA-mimiker overliste viralt enzymRepræsentationer af en B-DNA dobbelt helix og en enkelt spiralformet foldamer efterligner. Kredit:Ivan Huc, LMU Ikke alene kan syntetiske molekyler efterligne strukturerne i deres biologiske model
- Kemikere udvikler en ny metode til at identificere proteiner
- Maryland guvernør nedlægger veto mod lovforslag om permanent beskyttelse af østersreservater mod …
- Floridas østers i Apalachicola, Cedar Key står over for klimatrusler mod overlevelse
- Ingen Cinderellaer i syne: Brian Truongs March Madness Bracket, så langt
- Ingeniører foreslår solcelledrevet måneark som moderne global forsikring
- Den korte, tumultartet arbejdsliv for en baseballkande i major league


