Hvordan ligner to isotoper af et grundstof hinanden?
1. Samme atomnummer :Isotoper af samme grundstof har det samme antal protoner i deres atomkerner. Det betyder, at de deler det samme atomnummer, som entydigt identificerer grundstoffet. For eksempel har alle isotoper af kulstof seks protoner.
2. Kemiske egenskaber :Isotoper af et grundstof udviser generelt meget lignende kemiske egenskaber. De reagerer på samme måde og danner de samme typer forbindelser, da et grundstofs kemiske adfærd primært bestemmes af antallet af elektroner i dets yderste skal, som forbliver det samme for forskellige isotoper.
3. Lignende elektroniske konfigurationer :Bortset fra forskellen i antallet af neutroner, har isotoper af et grundstof det samme arrangement af elektroner i deres energiniveauer. Denne lignende elektroniske konfiguration fører til lignende atomare og molekylære strukturer, hvilket resulterer i sammenlignelig overordnet kemisk adfærd.
4. Samme position i det periodiske system :Isotoper indtager samme position i det periodiske system, fordi de har samme atomnummer. Derfor deler de lignende generelle egenskaber forbundet med deres position i det periodiske system, såsom gruppen (kolonne) og periode (række), som de tilhører.
5. Spektroskopiske egenskaber :Isotopers spektre viser ofte meget små forskelle, især i præcise målinger. Disse uoverensstemmelser opstår på grund af de lidt forskellige masser af isotoper, der påvirker deres vibrations- og rotationsenergier. Spektroskopiske teknikker kan bruges til at skelne mellem isotoper baseret på disse subtile spektrale variationer.
Samlet set deler isotoper af et grundstof forskellige grundlæggende egenskaber, herunder det samme atomnummer, identiske kemiske egenskaber, sammenlignelige elektroniske konfigurationer og den samme position i det periodiske system. De kan dog afvige lidt i visse fysiske egenskaber, såsom antallet af neutroner og den resulterende masseforskel.
 Varme artikler
Varme artikler
-
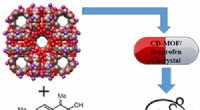 Længerevarende smertelindring med MOF'erKredit:American Chemical Society Til behandling af hovedpine, rygsmerter eller feber, de fleste af os har nået ibuprofen på et eller andet tidspunkt. Men vi skal ofte tage doser hver fjerde til sj
Længerevarende smertelindring med MOF'erKredit:American Chemical Society Til behandling af hovedpine, rygsmerter eller feber, de fleste af os har nået ibuprofen på et eller andet tidspunkt. Men vi skal ofte tage doser hver fjerde til sj -
 Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe
Fra identifikation til et kemisk fingeraftryk for sprængstoffer i retsmedicinsk forskningCobra fyrværkeri. Kredit:Karlijn Bezemer Politiet støder ofte på sprængstoffer i deres retsmedicinske efterforskninger relateret til kriminelle og terroraktiviteter. Kemisk analyse af sprængstoffe -
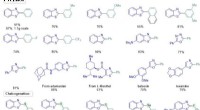 Krydskoblingsreaktioner:Semiheterogen PCN-Cu baseret metallafotokatalyseDobbelt Cu/halvleder fotokatalyseret C-H arylering, chalcogenering og C – N krydskoblingsreaktioner. Kredit:Science China Press For nylig, photoredox-katalyse har vist sig som en tiltalende koblin
Krydskoblingsreaktioner:Semiheterogen PCN-Cu baseret metallafotokatalyseDobbelt Cu/halvleder fotokatalyseret C-H arylering, chalcogenering og C – N krydskoblingsreaktioner. Kredit:Science China Press For nylig, photoredox-katalyse har vist sig som en tiltalende koblin -
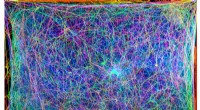 At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek
At lave musik fra edderkoppespindTværsnitsbilleder (vist i forskellige farver) af et edderkoppespind blev kombineret til dette 3D-billede og oversat til musik. Kredit:Isabelle Su og Markus Buehler Edderkopper er mesterbyggere, ek
- S. Koreas første luftbårne kamp mod kinesisk forurening mislykkes
- EU-lovgivere, Den britiske regulator presser Facebook om databrud
- Svamp skaber et hurtigt spor for kulstof
- Forskere undersøger kulturspecifikke traumeresponser i Schweiz
- Hvilket videnskabeligt instrument bruges til at måle en kraft?
- Sådan skriver du en resultatopgørelse for en T-test eller en ANOVA


