Hvad er kulstofs oxidationstilstand for ionisk ladning?
Positive oxidationstilstande:
1. +1: Kulstof kan have en +1 oxidationstilstand, når det danner en enkeltbinding med et elektronegativt atom og tre bindinger med hydrogenatomer. Et eksempel på dette er methylkationen (CH3+), hvor carbonatomet har en positiv ladning.
2. +2: Kulstof kan have en +2 oxidationstilstand, når det danner dobbeltbindinger med oxygen eller andre elektronegative atomer. Eksempler omfatter forbindelser som formaldehyd (HCHO), hvor carbonatomet er bundet til to oxygenatomer med dobbeltbindinger.
3. +3: I sjældne tilfælde kan kulstof også udvise en +3 oxidationstilstand, når det danner tredobbelte bindinger med elektronegative atomer eller er bundet til stærkt elektronegative grupper. Et eksempel er kuldioxid (CO2), hvor kulstofatomet er bundet til to oxygenatomer med dobbeltbindinger.
Negative oxidationstilstande:
Kulstof har typisk ikke negative oxidationstilstande, men det kan udvise en -4 oxidationstilstand i visse forbindelser kaldet carbanioner. Carbanioner er negativt ladede kulstofatomer, der skyldes tab af en proton (H+). De stabiliseres normalt af tilstedeværelsen af elektrontiltrækkende grupper eller tilstødende negative ladninger.
 Varme artikler
Varme artikler
-
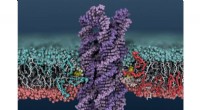 DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykkeEt syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo Et nyt syntetisk enzym, fremstillet af DNA frem for
DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykkeEt syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo Et nyt syntetisk enzym, fremstillet af DNA frem for -
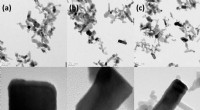 Ingeniører finder en smart måde at omdanne affaldskuldioxid til nyttigt materialeHR-TEM billeder for (a) ZnO-5, (b) ZnO-7 og (c) ZnO-9. Kredit: Avancerede energimaterialer (2020). DOI:10.1002/aenm.202001381 Kemiske ingeniører fra UNSW Sydney har udviklet ny teknologi, der hjæ
Ingeniører finder en smart måde at omdanne affaldskuldioxid til nyttigt materialeHR-TEM billeder for (a) ZnO-5, (b) ZnO-7 og (c) ZnO-9. Kredit: Avancerede energimaterialer (2020). DOI:10.1002/aenm.202001381 Kemiske ingeniører fra UNSW Sydney har udviklet ny teknologi, der hjæ -
 Ny tilgang til blødt materialestrøm kan give vej til nye materialer, katastrofeforudsigelseEn ny undersøgelse fra ingeniører ved University of Illinois, Urbana-Champaign bruger enkle eksperimenter til at forklare, hvordan en bedre forståelse af flydende bevægelse af bløde materialer vil hjæ
Ny tilgang til blødt materialestrøm kan give vej til nye materialer, katastrofeforudsigelseEn ny undersøgelse fra ingeniører ved University of Illinois, Urbana-Champaign bruger enkle eksperimenter til at forklare, hvordan en bedre forståelse af flydende bevægelse af bløde materialer vil hjæ -
 Med nyt værktøj til syntetisk biologi, forskere bruger bakterier til at fremkalde billederForskere fra University of Freiburg og ETH Zürich/Schweiz har udviklet et nyt optogenetisk værktøj og demonstreret dets effektivitet med en bakteriografi af Blade Runner (1982) filmplakaten. Kredit:Un
Med nyt værktøj til syntetisk biologi, forskere bruger bakterier til at fremkalde billederForskere fra University of Freiburg og ETH Zürich/Schweiz har udviklet et nyt optogenetisk værktøj og demonstreret dets effektivitet med en bakteriografi af Blade Runner (1982) filmplakaten. Kredit:Un
- Fra bronzealderen til maddåser, her er hvordan tin ændrede menneskeheden
- Forskning afslører nye aspekter af superledning og korrelerede fænomener
- PS4, Xbox One eller Nintendo Switch:Hvilken konsol skal du købe?
- Undersøgelse afslører detaljer om golfboldasteroide
- Undersøgelse undersøger konflikt mellem landmænd og husdyrdyr
- Fremskridt i karakteriseringen af billeder med højt dynamisk område


