Hvad er forbindelsen af bor?
* Borhydrider , de enkleste borforbindelser, indeholder hydrogenatomer bundet til bor. Mange borhydrider kaldes også boraner. Diboran (B2H6) og tetraboran (B4H10) er to almindelige boraner.
* Borhalogenider indeholder tre halogenidatomer (fluor, klor, brom eller jod) bundet til et boratom. Bortrifluorid (BF3) er for eksempel en farveløs gas, der reagerer kraftigt med vand.
* Boroxider (dibortrioxid, B2O3) og bornitrid (BN) har mere end ét boratom bundet sammen. Både boroxid og bornitrid er hvide faste stoffer.
Bor-oxygen-brint-forbindelser
* Borater , såsom natriumborat (borax, Na2B4O7-10H2O) og kaliumborat, er salte afledt af borsyre (H3BO3). Borater bruges til fremstilling af visse typer glas, sæber og kosmetik.
* Borsyre , en svag syre, bruges til konservering af træ, som et antiseptisk middel og til fremstilling af andre borforbindelser.
Andre borforbindelser
Bor danner også en række forbindelser med kulstof. Disse forbindelser er kendt som organoborforbindelser. De bruges til syntese af organiske materialer, såsom lægemidler og farvestoffer.
Bor danner både ioniske og kovalente forbindelser. I ioniske forbindelser fungerer bor som et metal, der danner positive ioner. I kovalente forbindelser fungerer bor som et ikke-metal, der deler elektroner med andre atomer for at danne molekyler.
Sidste artikelHar polære kovalente bindinger en positiv eller negativ ladning?
Næste artikelReagerer brombrintesyre med klor?
 Varme artikler
Varme artikler
-
 Maskinlæringstilgang kunne hjælpe med design af industrielle processer til lægemiddelfremstillingEt nyt computersystem forudsiger produkterne af kemiske reaktioner. Visionen er, at du vil være i stand til at gå hen til et system og sige, ‘Jeg vil lave dette molekyle.’ Softwaren fortæller dig den
Maskinlæringstilgang kunne hjælpe med design af industrielle processer til lægemiddelfremstillingEt nyt computersystem forudsiger produkterne af kemiske reaktioner. Visionen er, at du vil være i stand til at gå hen til et system og sige, ‘Jeg vil lave dette molekyle.’ Softwaren fortæller dig den -
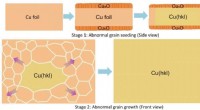 Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere
Indstilling af overfladen giver variationer til metalfolierDannelsesmekanisme for store krystallinske Cu -folier med forskellige overflader via annealering af peroxid -Cu -folier. Kredit:IBS Ligesom kloning i biologi muliggør oprettelse af en eller flere -
 Vandoverfladen er et fantastisk sted for kemiske reaktionerKredit:Pixabay/CC0 Public Domain Ved at bruge en avanceret teknik, forskere fra RIKEN-klyngen for banebrydende forskning har påvist, at en kemisk reaktion drevet af lys finder sted ti tusinde gang
Vandoverfladen er et fantastisk sted for kemiske reaktionerKredit:Pixabay/CC0 Public Domain Ved at bruge en avanceret teknik, forskere fra RIKEN-klyngen for banebrydende forskning har påvist, at en kemisk reaktion drevet af lys finder sted ti tusinde gang -
 Platform optimerer designet af nye, afstembare katalytiske systemerForskerne introducerede en samlingsmetode, hvor små, sfæriske partikler og matrixforstadier deponeres samtidigt fra en enkelt blanding for at producere fejlfrie film over centimeters skalaer. Forskern
Platform optimerer designet af nye, afstembare katalytiske systemerForskerne introducerede en samlingsmetode, hvor små, sfæriske partikler og matrixforstadier deponeres samtidigt fra en enkelt blanding for at producere fejlfrie film over centimeters skalaer. Forskern
- En ny æra på jagt efter 'søsterjorder'?
- 7 vidundere i den naturlige verden
- Ny nanoteknisk strategi viser potentiale for forbedret avanceret energilagring
- Hvad er lysafhængige reaktioner?
- Varme og tørre forhold i Storbritannien, der forårsager hidtil uset ekstrem fare for naturbrande
- Tektoniske plader svagere end tidligere antaget, siger videnskabsmænd


