Hvordan påvirker temperaturen, hvor hurtigt salt opløses i vand?
Forholdet mellem temperatur og opløsningshastigheden kan beskrives ved Arrhenius-ligningen:
```
k =Ae^(-Ea/RT)
```
hvor:
* k er hastighedskonstanten for opløsningsprocessen
* A er den præ-eksponentielle faktor
* Ea er aktiveringsenergien for opløsningsprocessen
* R er den ideelle gaskonstant
* T er temperaturen i Kelvin
Når temperaturen stiger, falder det eksponentielle led i Arrhenius-ligningen, hvilket resulterer i en højere værdi for k. Det betyder, at opløsningshastigheden stiger med stigende temperatur.
Overvej f.eks. opløsning af natriumchlorid (NaCl) i vand. Ved stuetemperatur (25°C) er hastighedskonstanten for opløsning af NaCl ca. 1,6 x 10^-6 mol/L-s. Hvis temperaturen øges til 50°C, stiger hastighedskonstanten til ca. 3,2 x 10^-6 mol/L-s. Dette indikerer, at opløsningshastigheden af NaCl i vand fordobles, når temperaturen øges fra 25°C til 50°C.
Temperaturens indvirkning på opløsningshastigheden er vigtig i forskellige industrielle og miljømæssige processer, der involverer opløsning af faste stoffer i væsker. Ved at kontrollere temperaturen kan opløsningshastigheden justeres for at opnå de ønskede resultater. For eksempel i fødevareindustrien bruges temperaturkontrol til at optimere udvindingen af smagsstoffer og næringsstoffer fra faste ingredienser under tilberedning af supper, saucer og drikkevarer. I den farmaceutiske industri bruges temperaturkontrol til at kontrollere frigivelseshastigheden af aktive ingredienser fra faste doseringsformer. I miljømæssige applikationer bruges temperaturkontrol til at forbedre opløsningen af forurenende stoffer og forurenende stoffer i vand til saneringsformål.
 Varme artikler
Varme artikler
-
 En metode til at konstruere krystaller med en stor brøkdel af reaktive facetterSkematisk illustration af syntesen af 3D-hm LSMO-katalysatorerne. Kredit:ResearchSEA Alsidige overbygninger sammensat af nanopartikler er for nylig blevet forberedt ved hjælp af forskellige demo
En metode til at konstruere krystaller med en stor brøkdel af reaktive facetterSkematisk illustration af syntesen af 3D-hm LSMO-katalysatorerne. Kredit:ResearchSEA Alsidige overbygninger sammensat af nanopartikler er for nylig blevet forberedt ved hjælp af forskellige demo -
 Lysaktiveret metalkatalysator ødelægger kræftcellernes vitale energikildeKredit:University of Warwick Et metal i en rumalder, der var en del af asteroiden, der ødelagde dinosaurerne, kunne give en ny metode til selektiv behandling af kræfttumorer ved hjælp af lys. For
Lysaktiveret metalkatalysator ødelægger kræftcellernes vitale energikildeKredit:University of Warwick Et metal i en rumalder, der var en del af asteroiden, der ødelagde dinosaurerne, kunne give en ny metode til selektiv behandling af kræfttumorer ved hjælp af lys. For -
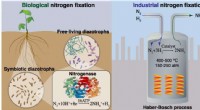 Udforskning af grønnere tilgange til nitrogenfikseringNitrogenfiksering forekommer naturligt i bakterier, der indeholder nitrogenase-enzymet, og kan udføres kunstigt gennem en højtemperatur- og højtryksindustriel proces, der er afhængig af jernbaserede k
Udforskning af grønnere tilgange til nitrogenfikseringNitrogenfiksering forekommer naturligt i bakterier, der indeholder nitrogenase-enzymet, og kan udføres kunstigt gennem en højtemperatur- og højtryksindustriel proces, der er afhængig af jernbaserede k -
 Forskere forstår endelig enzymernes arbejdsugeKredit:Københavns Universitet Enzymer bruges meget i vores hverdag. Som små soldater, enzymer i vaskepulver arbejder for at fjerne fedtpletter fra tøj, ligesom de bruges til at omdanne halm til bi
Forskere forstår endelig enzymernes arbejdsugeKredit:Københavns Universitet Enzymer bruges meget i vores hverdag. Som små soldater, enzymer i vaskepulver arbejder for at fjerne fedtpletter fra tøj, ligesom de bruges til at omdanne halm til bi
- Billede:Hubble fanger kuglehoben NGC 2298
- Street ERT'er er mere nyttige til at forudsige virksomheders fremtidige skatteudfald, undersøgelse …
- Uklart, om digital revolution sænker priserne - undersøgelse
- Er tyngdekraften en fast eller flydende gas noget andet?
- Husarbejde næsten ens mellem drenge og piger
- Sådan repareres naturen og undgå menneskelig elendighed:FN-rapport


