Hvad er forskellen mellem fosfor 31p og 32p?
1. Atomnummer:
Begge isotoper har det samme atomnummer på 15, hvilket betyder, at de begge har 15 protoner i deres atomkerne.
2. Massenummer:
Den største forskel mellem de to isotoper ligger i deres massetal. Fosfor-31 har et massetal på 31, hvilket betyder, at dens kerne indeholder 15 protoner og 16 neutroner. Fosfor-32 har på den anden side et massetal på 32, hvilket indikerer, at dens kerne indeholder 15 protoner og 17 neutroner.
3. Radioaktivitet:
Fosfor-32 er en radioaktiv isotop, hvilket betyder, at dens kerne er ustabil og kan gennemgå radioaktivt henfald og udsende partikler og energi i processen. Det har en halveringstid på omkring 14,3 dage, hvilket betyder, at det tager 14,3 dage for halvdelen af de radioaktive kerner at henfalde. I modsætning hertil er Phosphorus-31 en stabil isotop og undergår ikke radioaktivt henfald.
4. Applikationer:
På grund af sin radioaktivitet har Phosphorus-32 flere vigtige anvendelser:
- Radioaktivt sporstof: ³²P bruges som sporstof i biologisk og medicinsk forskning til at studere metaboliske processer og spore bevægelsen af fosforholdige molekyler i levende organismer.
- Strålebehandling: ³²P bruges i nogle former for strålebehandling, især til behandling af visse blodkræftformer såsom leukæmi og lymfom. Beta-partiklerne, der udsendes af ³²P, kan målrette og ødelægge kræftceller, samtidig med at skader på sundt væv minimeres.
- Industrielle applikationer: ³²P bruges også i nogle industri- og fremstillingsprocesser, såsom måling af tykkelsen af materialer og detektering af fejl i metaldele.
5. Naturlig overflod:
I naturen er Phosphorus-31 den mest udbredte isotop, der udgør omkring 99,99% af alt naturligt forekommende fosfor. Fosfor-32 er en meget sjældnere isotop, der kun tegner sig for omkring 0,01% af det naturligt forekommende fosfor.
Sidste artikelSammenlignet med 31P har den radioaktive isotop 32P?
Næste artikelHvad er et produkt af benzin og vand?
 Varme artikler
Varme artikler
-
 Retsmedicinsk analysemetode for læbestiftsspor udvikletKredit:Unsplash/CC0 Public Domain Retsmedicinere finder en ny måde at identificere mærker af læbestift på et gerningssted uden at fjerne beviser fra tasken. Ved hjælp af en teknik kaldet Raman -s
Retsmedicinsk analysemetode for læbestiftsspor udvikletKredit:Unsplash/CC0 Public Domain Retsmedicinere finder en ny måde at identificere mærker af læbestift på et gerningssted uden at fjerne beviser fra tasken. Ved hjælp af en teknik kaldet Raman -s -
 Bærbar biosensor advarer mod hjerteanfald og slagtilfældeDen bærbare måleenhed med USB -interface til tilslutning til bærbar computer. Softwaren installeret i bærbar computer giver GUI til at styre måleparametre og vise testresultaterne. Indsæt viser den em
Bærbar biosensor advarer mod hjerteanfald og slagtilfældeDen bærbare måleenhed med USB -interface til tilslutning til bærbar computer. Softwaren installeret i bærbar computer giver GUI til at styre måleparametre og vise testresultaterne. Indsæt viser den em -
 Ingeniører laver den grundlæggende byggesten til elektrospundne nanofibreSelvom polymermaterialets tekstur er synlig for det blotte øje, mikroskopiske billeder afslører forviklingen af lommer og tråde i strukturen. Kredit:Smitha Rao/Michigan Tech Elektrospinning brug
Ingeniører laver den grundlæggende byggesten til elektrospundne nanofibreSelvom polymermaterialets tekstur er synlig for det blotte øje, mikroskopiske billeder afslører forviklingen af lommer og tråde i strukturen. Kredit:Smitha Rao/Michigan Tech Elektrospinning brug -
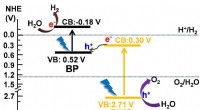 Ultratyndt sort fosfor til solcelledrevet brintøkonomiFig.1. Skematisk diagram over Z-skema fotokatalytisk overordnet vandopdeling ved hjælp af BP/BiVO4 under bestråling af synligt lys. Kredit:Osaka University Brint som brændstofkilde, frem for kulbr
Ultratyndt sort fosfor til solcelledrevet brintøkonomiFig.1. Skematisk diagram over Z-skema fotokatalytisk overordnet vandopdeling ved hjælp af BP/BiVO4 under bestråling af synligt lys. Kredit:Osaka University Brint som brændstofkilde, frem for kulbr
- Hvordan opstiller man formlen for kviksølv 2 nitrat?
- Hvornår er latter et medicinsk symptom?
- eROSITA leverer første slående billeder
- Forskere bruger elektrostatisk ladning til at samle partikler til materialer, der efterligner ædels…
- Hvordan fitness-influentere spiller algoritmerne for at pumpe deres engagement op
- NASAs Swift hjælper med at binde neutrino til stjerneknusende sort hul


