Hvorfor eksisterer svovl som S8?
1. Stærke intermolekylære kræfter: Svovlatomer har en relativt stor atomradius og lav elektronegativitet, hvilket resulterer i svage van der Waals-kræfter mellem individuelle svovlatomer. Imidlertid bliver den kumulative effekt af disse svage kræfter betydelig i større molekyler som S8, hvilket bidrager til dets stabilitet.
2. Cyklisk struktur: S8 vedtager en rynket eller kroneformet cyklisk struktur, hvor hvert svovlatom er kovalent bundet til to nabostillede svovlatomer. Denne ringstruktur øger yderligere stabiliteten af S8-molekylet ved at fordele elektrontætheden mere jævnt og reducere potentielle elektrostatiske frastødninger.
3. Termodynamisk stabilitet: Dannelsen af S8 er termodynamisk gunstig under standardbetingelser. Entalpiændringen (ΔH) og entropiændringen (ΔS) forbundet med transformationen af individuelle svovlatomer til S8 er begge negative, hvilket indikerer, at processen er eksoterm og fører til et fald i uorden.
4. Elektronisk konfiguration: Svovl har seks valenselektroner (3s² 3p⁴), og i S8 deler hvert svovlatom to af dets valenselektroner med to nabostillede svovlatomer og danner kovalente bindinger. Dette arrangement resulterer i en stabil oktetkonfiguration for hvert svovlatom, hvilket bidrager til den samlede stabilitet af S8-molekylet.
5. Inert pareffekt: Svovl tilhører gruppe 16 i det periodiske system, og det udviser den inerte pareffekt. Dette betyder, at 3s² elektronparret i svovl er relativt inert og ikke uden videre deltager i bindingen. Som et resultat involverer bindingen i S8 primært 3p orbitaler, hvilket yderligere bidrager til stabiliteten af den cykliske struktur.
Disse faktorer forklarer tilsammen, hvorfor svovl primært eksisterer som S8 under standardbetingelser. Det er dog værd at bemærke, at andre allotroper af svovl, såsom S2, S6 og polymert svovl, også kan eksistere under specifikke forhold eller i forskellige miljøer.
 Varme artikler
Varme artikler
-
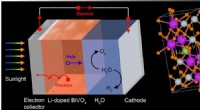 Kørevandsspaltning for at skabe kemiske brændstoffer(Venstre) Under sollys, vismutvanadat (BiVO4) - et lovende elektrodemateriale til vandspaltning - genererer elektron-hul-par (ladningsbærere) for at spalte vand til brint og oxygengas. Ved doping, el
Kørevandsspaltning for at skabe kemiske brændstoffer(Venstre) Under sollys, vismutvanadat (BiVO4) - et lovende elektrodemateriale til vandspaltning - genererer elektron-hul-par (ladningsbærere) for at spalte vand til brint og oxygengas. Ved doping, el -
 Forskere skaber en ny type intelligent materialeTeamet, der skabte 2D-elektrolytterne, blev ledet af prof. Antonio Castro Neto (til højre), Direktør for CA2DM. Med ham er fru Mariana Costa (til venstre), publikationens første forfatter. Kredit:Nati
Forskere skaber en ny type intelligent materialeTeamet, der skabte 2D-elektrolytterne, blev ledet af prof. Antonio Castro Neto (til højre), Direktør for CA2DM. Med ham er fru Mariana Costa (til venstre), publikationens første forfatter. Kredit:Nati -
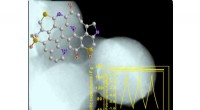 Højt nitrogen og svovl dobbelt-dopede kulstofmikrosfærer til superkondensatorerDenne figur viser morfologien, molekylær model og cyklisk ydeevne af den N/S co-doterede kulstofmikrosfære. Kredit:©Science China Press Blandt elektrodematerialer til superkondensatorer, kulstofba
Højt nitrogen og svovl dobbelt-dopede kulstofmikrosfærer til superkondensatorerDenne figur viser morfologien, molekylær model og cyklisk ydeevne af den N/S co-doterede kulstofmikrosfære. Kredit:©Science China Press Blandt elektrodematerialer til superkondensatorer, kulstofba -
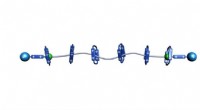 Lille pumpe bygger polyrotaxaner med præcisionNorthwestern University forskere har udviklet den mest præcise måde at bygge polyrotaxaner på, en mekanisk låst polymer til glidering geler, batterielektrodematerialer og platforme til levering af læg
Lille pumpe bygger polyrotaxaner med præcisionNorthwestern University forskere har udviklet den mest præcise måde at bygge polyrotaxaner på, en mekanisk låst polymer til glidering geler, batterielektrodematerialer og platforme til levering af læg
- Amerikanske havniveau-rapportkort:2020 tendenser igen mod acceleration
- Hvordan vores økonomi kan overleve pandemien
- Instrumenter til overvågning af vulkaner
- Hvad danner cellevæggen i planteceller?
- Hvorfor overfladematerialer betyder noget i sundhedsmiljøer
- Åndbar, bærbar elektronik på huden til langsigtet sundhedsovervågning


