Hvad sker der med PH-værdien af reaktionsblandingen under neutralisering?
1. Indledende:
- Før blanding af syre og base afhænger reaktionsblandingens pH af udgangsmaterialerne:
- Hvis opløsningen indeholder en stærkere syre, vil pH være lavere (mere sur).
- Hvis opløsningen indeholder en stærkere base, vil pH være højere (mere basisk).
2. Blanding:
- Når syren og basen blandes, begynder reaktionen, og hydrogenionerne (H+) fra syren begynder at kombineres med hydroxidionerne (OH-) fra basen og danner vand (H2O).
3. pH-ændringer:
- Efterhånden som reaktionen skrider frem, falder koncentrationen af H+ og OH- ioner i opløsningen. Dette fald får blandingens pH-værdi til at skifte mod en neutral værdi (pH =7).
- pH-værdien vil gradvist stige, hvis den oprindelige opløsning var sur (fra lav pH-værdi til 7) eller falde, hvis den var basisk (fra høj pH-værdi til 7).
4. Slutpunkt:
- På et bestemt tidspunkt kaldet ækvivalenspunktet , vil reaktanterne være til stede i støkiometrisk lige store mængder, og deres fuldstændige neutralisering vil finde sted.
- På dette tidspunkt vil opløsningens pH være præcis 7 , hvilket indikerer en neutral løsning.
5. Beyond Endpoint:
- Hvis du tilsætter mere syre efter at have nået ækvivalenspunktet, vil H+ ionerne fra den overskydende syre få pH til at falde til under 7, hvilket gør opløsningen sur igen.
- Tilsvarende vil tilsætning af mere base efter ækvivalenspunktet øge OH-koncentrationen, hæve pH til over 7 og gøre opløsningen basisk.
 Varme artikler
Varme artikler
-
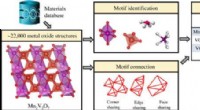 Struktur motiv-centreret læringsramme for uorganiske krystallinske systemerEkstraktion af strukturmotivinformation i uorganiske krystallinske forbindelser (metaloxider) og generering af globale motivrepræsentationer ved hjælp af motivmiljømatrixen. Kredit: Videnskab fremskri
Struktur motiv-centreret læringsramme for uorganiske krystallinske systemerEkstraktion af strukturmotivinformation i uorganiske krystallinske forbindelser (metaloxider) og generering af globale motivrepræsentationer ved hjælp af motivmiljømatrixen. Kredit: Videnskab fremskri -
 Sundhedsbehandling gennem kemisk synteseArbejder i farmaceutisk kemi, vores primære mål er at forberede molekyler til at tackle sundhedsproblemer – Vittorio Pace er gruppeleder i syntetisk kemi ved universitetet i Wien. Kredit:rizenagard/pi
Sundhedsbehandling gennem kemisk synteseArbejder i farmaceutisk kemi, vores primære mål er at forberede molekyler til at tackle sundhedsproblemer – Vittorio Pace er gruppeleder i syntetisk kemi ved universitetet i Wien. Kredit:rizenagard/pi -
 Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator
Computervision hjælper forskere med at studere lithium-ion-batterierEn ny computervisionsalgoritme til at identificere partikler i en lithium-ion batteri katode har hjulpet forskere med at spore katodens nedbrydning over tid. Kredit:Yijin Liu/SLAC National Accelerator -
 Ny fotokatalysator omdanner effektivt kuldioxid til metanbrændstof med lysDr. Ng og hans team syntetiserede en ny fotokatalysator ved at indpakke kobberoxid med kobberbaserede metal-organiske rammer. Kredit:City University of Hong Kong Kuldioxid (CO 2 ) er en af de
Ny fotokatalysator omdanner effektivt kuldioxid til metanbrændstof med lysDr. Ng og hans team syntetiserede en ny fotokatalysator ved at indpakke kobberoxid med kobberbaserede metal-organiske rammer. Kredit:City University of Hong Kong Kuldioxid (CO 2 ) er en af de
- Små halvledende krystaller viser løfte for solcellearkitekturer og lysemitterende enheder
- Hvad er 'lavtydende' atomvåben?
- Hvad sker der, når en vulkanens centrale ventil blokeres?
- Ny teknik lader forskere skabe modstandsfrie elektronkanaler
- Biokompatible TeSex nano-legeringer til PT/PA/CT/PET billedbehandlingsstyret NIR-II-fototermisk tera…
- Hvordan maskinlæring hjalp med at udvikle en ny algoritme, der kunne tilføre liv til broer


