Cumen er en forbindelse, der kun indeholder kulstof og brint, der bruges til fremstilling af acetone phenol kemisk industri. Forbrænding 47,6 mg cumen producerer noget CO2 42,8 vand?
Vi kan starte med at bestemme antallet af mol kulstof og brint i den givne masse cumen (47,6 mg).
Trin 1:Beregn antallet af mol CO2 og H2O
Fra forbrændingsreaktionen ved vi, at 47,6 mg cumen giver 42,8 mg vand.
Den molære masse af CO2 er 44,01 g/mol, og den molære masse af H2O er 18,02 g/mol.
Antal mol CO2 =(42,8 mg) / (44,01 g/mol) =0,000972 mol
Antal mol H2O =(47,6 mg) / (18,02 g/mol) =0,00264 mol
Trin 2:Bestem mol af C og H
Da hvert CO2-molekyle indeholder et kulstofatom, er antallet af mol kulstof lig med antallet af mol CO2.
Mol af C =Antal mol CO2 =0,000972 mol
Hvert H2O-molekyle indeholder to brintatomer, så antallet af mol hydrogen er det dobbelte af antallet af mol H2O.
Mol H =2 x Antal mol H2O =2 x 0,00264 mol =0,00528 mol
Trin 3:Find det enkleste hele talforhold
For at finde det enkleste hele talforhold skal vi dividere både antallet af kulstof- og brintmol med det mindste antal mol. I dette tilfælde er det mindste antal mol 0,000972 mol (mol kulstof).
Mol af C / 0,000972 mol =0,000972 / 0,000972 =1
Mol H / 0,000972 mol =0,00528 / 0,000972 =5,5
Trin 4:Skriv den empiriske formel
Den empiriske formel er skrevet ved hjælp af hele talforholdet opnået i trin 3.
C:H =1:5,5
Da empiriske formler altid skrives i det enkleste hele talforhold, skal vi gange forholdet med 2 for at få den mest ligetil formel.
C:H =2:11
Derfor er den empiriske formel for cumen C2H11.
Sidste artikelHvad sker der med PH-værdien af reaktionsblandingen under neutralisering?
Næste artikelHvad er oxidationstallet for N?
 Varme artikler
Varme artikler
-
 Udvikling af enzymer til at hjælpe med at løse planetens plastikproblemKredit:Unsplash/CC0 Public Domain Forskere fra Manchester Institute of Biotechnology (MIB) har udviklet en ny enzymteknologisk platform til at forbedre plastnedbrydende enzymer gennem rettet evolut
Udvikling af enzymer til at hjælpe med at løse planetens plastikproblemKredit:Unsplash/CC0 Public Domain Forskere fra Manchester Institute of Biotechnology (MIB) har udviklet en ny enzymteknologisk platform til at forbedre plastnedbrydende enzymer gennem rettet evolut -
 Ny cellulær billeddannelse baner vej for kræftbehandlingEt menneske, et enzym og nogle gelbånd - fluorescerende billeddannende midler visualiserer enzymaktivitet i sundt og sygt væv. Dette vil hjælpe med design og vurdering af mere effektive lægemidler mod
Ny cellulær billeddannelse baner vej for kræftbehandlingEt menneske, et enzym og nogle gelbånd - fluorescerende billeddannende midler visualiserer enzymaktivitet i sundt og sygt væv. Dette vil hjælpe med design og vurdering af mere effektive lægemidler mod -
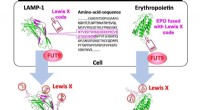 Forskerhold identificerer en molekylær kode indlejret i protein til regulering af dets glykosylerin…Specifik 29-aminosyresekvens fra LAMP-1 tjener som en Lewis X-kode, som dechifreres af FUT9, og den kan indlejres i erythropoietin for at fremkalde Lewis X-modifikation. Kredit:Nagoya City University
Forskerhold identificerer en molekylær kode indlejret i protein til regulering af dets glykosylerin…Specifik 29-aminosyresekvens fra LAMP-1 tjener som en Lewis X-kode, som dechifreres af FUT9, og den kan indlejres i erythropoietin for at fremkalde Lewis X-modifikation. Kredit:Nagoya City University -
 En billig organisk dampgenerator til at rense vandVarmen fra solen fordamper vandet, mens salt og andre materialer forbliver tilbage. Kredit:Thor Balkhed Det er blevet anslået, at en fjerdedel af verdens børn i 2040 vil bo i regioner, hvor der ma
En billig organisk dampgenerator til at rense vandVarmen fra solen fordamper vandet, mens salt og andre materialer forbliver tilbage. Kredit:Thor Balkhed Det er blevet anslået, at en fjerdedel af verdens børn i 2040 vil bo i regioner, hvor der ma
- Var der beviser for at bevise, at flogistonteorien var korrekt?
- Forskning afslører konsekvenserne for sikkerhed og sundhed på arbejdspladsen af outsourcing
- Ultrahurtig multitarget kontrol af tæt fokuserede lysfelter
- Hvilken slags energi produceres, når man går op i en trappe?
- US Interior Dept godkender olieboring i arktisk tilflugtssted
- En hest døde på settet til 'The Rings Power':Sådan sikrer du velfærdsheste brugt i underholdning…


