Hvad er de kemiske egenskaber af plutonium?
- Atomnummer: 94
- Atomvægt: 244
- Elektronkonfiguration: [Rn] 5f6 7s2
- Oxidationstilstande: +3, +4, +5, +6
- Radioaktiv: Ja, alfa- og beta-emitter
- Smeltepunkt: 640 °C (1.184 °F)
- Kogepunkt: 3.227 °C (5.841 °F)
- Tæthed: 19,86 g/cm³
- Farve: Sølvfarvet-hvid
Kemisk reaktivitet
Plutonium er et meget reaktivt metal, der anløber i luft og reagerer med vand for at danne plutoniumhydroxid. Det er også pyrofor, hvilket betyder, at det kan antændes spontant i luft ved stuetemperatur. Plutonium er opløseligt i syrer, men ikke i alkalier.
Oxidationstilstande
Plutonium kan eksistere i en række forskellige oxidationstilstande, herunder +3, +4, +5 og +6. Den mest almindelige oxidationstilstand er +3, som findes i plutonium(III)-forbindelser. Plutonium(IV)-forbindelser er også almindelige, og de oxideres typisk til plutonium(VI)-forbindelser i luft. Plutonium(V)-forbindelser er sjældne, og de er typisk ustabile.
Radioaktivitet
Plutonium er et radioaktivt grundstof, der udsender alfa- og beta-partikler. Alfa-partikler er heliumkerner, mens beta-partikler er elektroner. Alfapartiklerne, der udsendes af plutonium, er meget energiske og kan rejse flere centimeter i luften. Beta-partiklerne, der udsendes af plutonium, er mindre energiske og kan kun rejse nogle få millimeter i luften.
Toksicitet
Plutonium er et meget giftigt element, der kan forårsage en række sundhedsproblemer, herunder kræft, fødselsdefekter og strålingsforgiftning. Plutonium er også et teratogent, hvilket betyder, at det kan forårsage fosterskader, hvis det indtages af en gravid kvinde.
Anvendelser
Plutonium bruges som brændstof i atomreaktorer og som en del af atomvåben. Det bruges også i nogle medicinske anvendelser, såsom behandling af kræft.
Plutonium er et farligt grundstof, der skal håndteres med forsigtighed. Det er vigtigt at være opmærksom på plutoniums kemiske egenskaber for sikkert at arbejde med det.
Sidste artikelstøder du på brint?
Næste artikelHvad laver forbindelser plutonium?
 Varme artikler
Varme artikler
-
 Forskere gør ananasaffald til aerogeler af høj værdiFormosa ananas i Filippinerne. Næsten tre gange så meget ananasbladaffald genereres for hvert kilo produceret frugt. Kredit:Judgefloro Høst af ananas, en udbredt tropisk frugt, efterlader tonsvis
Forskere gør ananasaffald til aerogeler af høj værdiFormosa ananas i Filippinerne. Næsten tre gange så meget ananasbladaffald genereres for hvert kilo produceret frugt. Kredit:Judgefloro Høst af ananas, en udbredt tropisk frugt, efterlader tonsvis -
 Maskinindlæring revner krystalstrukturenes oxidationstilstandeKredit:CC0 Public Domain Kemiske grundstoffer udgør stort set alt i den fysiske verden. Fra 2016 vi kender til 118 elementer, som alle kan findes kategoriseret i det berømte periodiske system, der
Maskinindlæring revner krystalstrukturenes oxidationstilstandeKredit:CC0 Public Domain Kemiske grundstoffer udgør stort set alt i den fysiske verden. Fra 2016 vi kender til 118 elementer, som alle kan findes kategoriseret i det berømte periodiske system, der -
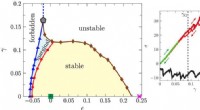 Er amorfe faste stoffer elastiske eller plastiske?Til venstre:Stabilitets-reversibilitetskort over amorfe faste stoffer i hårde kugler, repræsenteret med hensyn til volumen og forskydningsbelastninger. Til højre:Typiske stress-strain-kurver, som vise
Er amorfe faste stoffer elastiske eller plastiske?Til venstre:Stabilitets-reversibilitetskort over amorfe faste stoffer i hårde kugler, repræsenteret med hensyn til volumen og forskydningsbelastninger. Til højre:Typiske stress-strain-kurver, som vise -
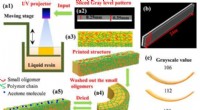 4-D-print, vendbare formændrende materialer med lysbaseret gråtonemønsterGråskala 4D-printmetoden a1) skemaer af metoden med digital lysbehandling (DLP), a2) repræsentativt gråtonemønster til udskrivning, a3) diagrammer af en trykt struktur med forskellig tværbindingstæthe
4-D-print, vendbare formændrende materialer med lysbaseret gråtonemønsterGråskala 4D-printmetoden a1) skemaer af metoden med digital lysbehandling (DLP), a2) repræsentativt gråtonemønster til udskrivning, a3) diagrammer af en trykt struktur med forskellig tværbindingstæthe
- Pakistan går imod kornet med kulkraft
- Bevis for indrammet grafen-membranoverbygning åbner en membranspecifik lægemiddeltilførselstilsta…
- Elfenbenskysten producerer rekordhøj kakaoafgrøde
- At bryde reglerne:Tunge kemiske grundstoffer ændrer teorien om kvantemekanik
- Forskere afslører en vej til at finde ud af, hvad der gør individer søde eller grimme
- Kommer energien fra fordampning fra solen?


