Hvorfor reagerer mineraler og HCl ikke?
Carbonatmineraler:Mineraler, der indeholder carbonationer (CO3²⁻), såsom calcit (calciumcarbonat) og dolomit (calciummagnesiumcarbonat), reagerer med HCl for at producere kuldioxidgas (CO2). Reaktionen frembringer opbrusning eller bobler, når gassen undslipper.
For eksempel:
CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g)
Metalsulfider:Visse metalsulfider, såsom jernsulfid (FeS) og kobbersulfid (CuS), reagerer med HCl for at danne de tilsvarende metalchlorider og frigive hydrogensulfidgas (H2S). Denne reaktion er ofte ledsaget af dannelsen af et sort bundfald.
For eksempel:
FeS(s) + 2HCl(aq) → FeCl2(aq) + H2S(g)
Silikatmineraler:Nogle silikatmineraler, især dem, der indeholder let forvitrede elementer som jern og magnesium, kan reagere med HCl. For eksempel kan visse lermineraler og zeolitter gennemgå ionbytterreaktioner med HCl, hvilket fører til frigivelse af metalioner i opløsningen.
Det er dog vigtigt at bemærke, at ikke alle mineraler reagerer med HCl. Mineraler, der primært består af elementer som kulstof (grafit), svovl (native svovl) eller guld er generelt inerte over for HCl, fordi de mangler reaktive funktionelle grupper. Mineraler med en høj grad af kemisk stabilitet, såsom kvarts (siliciumdioxid) og zircon (zirconiumsilikat), har også en tendens til at være resistente over for HCl.
Samlet set er reaktiviteten af mineraler med HCl meget afhængig af den specifikke mineralsammensætning og kemiske egenskaber. Mens nogle mineraler kan gennemgå reaktioner med HCl, kan andre forblive inerte og ikke-reaktive.
Sidste artikelHvor mange mol Na2Cro4 er der i 74,3 gram af forbindelsen?
Næste artikelReagerer ZnCl2 med fortyndet HCl?
 Varme artikler
Varme artikler
-
 Vil dit fremtidige tøj være lavet af alger?En mini-T-shirt demonstrerer de fotosyntetiske levende materialer skabt i laboratoriet af University Rochester biolog Anne S. Meyer og Delft University of Technology bionanoforsker Marie-Eve Aubin-Tam
Vil dit fremtidige tøj være lavet af alger?En mini-T-shirt demonstrerer de fotosyntetiske levende materialer skabt i laboratoriet af University Rochester biolog Anne S. Meyer og Delft University of Technology bionanoforsker Marie-Eve Aubin-Tam -
 Bionedbrydelige flip-flops kommer snartZuzana Sediva ønsker at producere plastskum fra organisk affald. Kredit:Stefan Weiss, partnere i GmbH / ETH Zürich Bionedbrydeligt plast er meget på trend. Men der er stadig meget få bæredygtige a
Bionedbrydelige flip-flops kommer snartZuzana Sediva ønsker at producere plastskum fra organisk affald. Kredit:Stefan Weiss, partnere i GmbH / ETH Zürich Bionedbrydeligt plast er meget på trend. Men der er stadig meget få bæredygtige a -
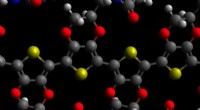 Cyborg-teknologi kunne muliggøre ny diagnostik, fusion af mennesker og AIMolekylær model af PEDOT med maleimid; kulstofatomer er grå, oxygen røde, nitrogen blå, svovler gule og hydrogener hvide. Kredit:David Martin Selvom sande cyborgs - delvist er menneskelige, delvis
Cyborg-teknologi kunne muliggøre ny diagnostik, fusion af mennesker og AIMolekylær model af PEDOT med maleimid; kulstofatomer er grå, oxygen røde, nitrogen blå, svovler gule og hydrogener hvide. Kredit:David Martin Selvom sande cyborgs - delvist er menneskelige, delvis -
 Frysning af celler gjort sikrere takket være ny polymerCellerne frosset med polymeren (venstre) og uden polymeren (højre). Kredit:University of Warwick Cellefrysning (cryopreservation) - hvilket er essentielt i celletransfusioner såvel som grundlæggen
Frysning af celler gjort sikrere takket være ny polymerCellerne frosset med polymeren (venstre) og uden polymeren (højre). Kredit:University of Warwick Cellefrysning (cryopreservation) - hvilket er essentielt i celletransfusioner såvel som grundlæggen
- NASA ser den tropiske storm Emily før og efter landfald
- ASU arbejder på at redde hawaiianske koralrev under indtræden af en ny havhedebølge
- Heads-up, CEO'er – virksomhedernes sociale ansvar kan få dig fyret, undersøgelse finder
- Forskere udtænker en ny måde at undersøge bevægelsen af lavenergi-elektroner på
- Sådan konverteres TDS til konduktivitet
- Total solformørkelse 2024:Månens øjeblik i solen


