Hvilket molekyle betragtes som en base i Lewis-modellen, men ikke Bronsted-Lowry eller Arrhenius-modellen?
Lewis Base :En Lewis-base er en art, der kan donere et elektronpar. I Lewis-modellen betragtes NH$_3$ som en base, fordi den har et ensomt elektronpar på nitrogenatomet, som kan doneres. Dette ensomme par kan interagere med en Lewis-syre (en art, der kan acceptere et elektronpar) for at danne en koordineret kovalent binding.
Bronsted-Lowry Base :En Bronsted-Lowry base er en art, der kan acceptere en proton (H$^+$). I Bronsted-Lowry-modellen betragtes NH$_3$ ikke som en base, fordi den ikke har nogen sure protoner, der kan doneres.
Arrhenius-base :En Arrhenius-base er en art, der producerer hydroxidioner (OH$^-$), når de opløses i vand. I Arrhenius-modellen betragtes NH$_3$ ikke som en base, fordi det ikke producerer OH$^-$ ioner, når det opløses i vand. I stedet reagerer det med vand og danner ammoniumhydroxid (NH$_4$OH), som er en svag base.
Derfor betragtes NH$_3$ kun som en base i Lewis-modellen, men ikke i Bronsted-Lowry- eller Arrhenius-modellerne.
 Varme artikler
Varme artikler
-
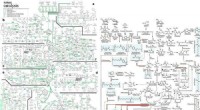 Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re
Et omfattende metabolisk kort til produktion af biobaserede kemikalierBiobaseret kemikalieproduktion ad biologiske og kemiske veje. Dette metaboliske kort beskriver repræsentative kemikalier, der kan fremstilles enten ved biologiske og/eller kemiske midler. Røde pile re -
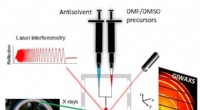 Røntgenstråler afslører in situ krystalvækst af blyfrie perovskit solpanelmaterialerEt skema over den eksperimentelle opsætning, der bruges til at undersøge den strukturelle dannelse af perovskites tynde film under spinbelægning. Kredit:G.Portale, University of Groningen Blybaser
Røntgenstråler afslører in situ krystalvækst af blyfrie perovskit solpanelmaterialerEt skema over den eksperimentelle opsætning, der bruges til at undersøge den strukturelle dannelse af perovskites tynde film under spinbelægning. Kredit:G.Portale, University of Groningen Blybaser -
 Kunne ungt blod holde hemmeligheder længere, sundere liv?Kredit:offentligt domæne I det der lyder som en scene fra en science fiction -film, forskere i 2005 syede gamle og unge mus sammen, så de delte et kredsløbssystem. Ungdommeligt blod foryngede tils
Kunne ungt blod holde hemmeligheder længere, sundere liv?Kredit:offentligt domæne I det der lyder som en scene fra en science fiction -film, forskere i 2005 syede gamle og unge mus sammen, så de delte et kredsløbssystem. Ungdommeligt blod foryngede tils -
 Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
Stort skridt i at producere kulstofneutralt brændstof:sølvdiphosphidKredit:CC0 Public Domain En ny kemisk proces beskrevet i tidsskriftet Naturkommunikation gør i laboratoriet, hvad træer gør i naturen - det omdanner kuldioxid til brugbare kemikalier eller brænd
- Det første komplette dinosaurskelet, der nogensinde er fundet, er endelig klar til nærbilledet
- Hvad er organisk udvikling?
- Svedesensor registrerer stressniveauer; Kan finde brug i rumforskning
- Kemisk vs. Fysiske reaktioner
- Økonomisk indvirkning på kyst erosion
- Overvågning af Matterhorn med millioner af datapunkter


