Hvor mange mol er der i en gasprøve på 0,325 liters beholder ved 0,914 ATM og 19 grader Celsius?
PV =nRT
Hvor P er trykket, V er volumenet, n er antallet af mol, R er den ideelle gaskonstant, og T er temperaturen.
Givet følgende værdier:
P =0,914 atm
V =0,325 L
T =19 grader Celsius =292 K
R =0,08206 L atm/mol K
Vi kan omarrangere den ideelle gaslov til at løse for n:
n =PV/RT
Erstatning af de givne værdier:
n =(0,914 atm)(0,325 L) / (0,08206 L atm / mol K)(292 K)
n =0,0129 mol
Derfor er der 0,0129 mol gas i beholderen på 0,325 liter under de givne forhold.
 Varme artikler
Varme artikler
-
 De udvidede muligheder for biobaserede polymererKredit:Institut for Kemisk Forskning i Catalonien At finde innovative og bæredygtige løsninger til vores materialebehov er et af kernemålene for grøn kemi. De utallige plastik, der omslutter vores
De udvidede muligheder for biobaserede polymererKredit:Institut for Kemisk Forskning i Catalonien At finde innovative og bæredygtige løsninger til vores materialebehov er et af kernemålene for grøn kemi. De utallige plastik, der omslutter vores -
 Materialeforskere opdager designhemmeligheder for et næsten uforgængeligt insektHjemmehørende i ørkenhabitater i det sydlige Californien, den djævelske jernbeklædte bille har et eksoskelet, der er et af de hårdeste, de fleste knusningsresistente strukturer, der vides at eksistere
Materialeforskere opdager designhemmeligheder for et næsten uforgængeligt insektHjemmehørende i ørkenhabitater i det sydlige Californien, den djævelske jernbeklædte bille har et eksoskelet, der er et af de hårdeste, de fleste knusningsresistente strukturer, der vides at eksistere -
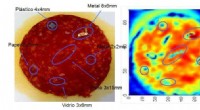 Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub
Design af sensorer til at detektere fremmedlegemer i fødevarerBillede opnået med denne teknologi, hvor der kan ses, på et stykke pølse, plast, metaller og splinter af glas i forskellige størrelser og former. Kredit:Elhuyar Fundazioa Forskere ved NUP/UPNA-Pub -
 Effekter af tværbinderlængde på anionbyttermembranbrændselscellerFremskridt inden for brændselscelleteknologi vil hjælpe os kraftigt med at reducere vores brug af fossile brændstoffer til at generere elektricitet, fører til mindre luftforurening. Kredit:Chris LeBou
Effekter af tværbinderlængde på anionbyttermembranbrændselscellerFremskridt inden for brændselscelleteknologi vil hjælpe os kraftigt med at reducere vores brug af fossile brændstoffer til at generere elektricitet, fører til mindre luftforurening. Kredit:Chris LeBou
- Data viser, hvordan pandemien ændrede dagligdagen
- Penn Museum bruger det seneste inden for videnskab til at bevare de ældste artefakter
- Det største nogensinde kort over universers aktive supermassive sorte huller frigivet
- Vandforudsigelser:Fortæller, hvornår en nanolitografiskimmel vil bryde gennem dråber
- Hvad er giftige gasser?
- Nogle bærbare Apple-computere er forbudt at flyve med fly på grund af brandfare


