Hvad bestemmer valenselektroner?
1. Kemisk binding:Valenselektroner er elektronerne i den yderste skal af et atom, der deltager i kemisk binding. Antallet og arrangementet af valenselektroner bestemmer typen og styrken af kemiske bindinger, som et grundstof kan danne med andre grundstoffer.
2. Reaktivitet:Et grundstofs reaktivitet, som refererer til dets tendens til at gennemgå kemiske reaktioner, er i høj grad bestemt af dets valenselektroner. Grundstoffer med flere valenselektroner har en tendens til at være mere reaktive, fordi de har en større tendens til at miste eller få elektroner for at opnå en stabil elektronkonfiguration.
3. Periodiske tendenser:Det periodiske system arrangerer grundstofferne efter deres atomnummer, hvilket igen bestemmer antallet af valenselektroner, de har. Grundstoffer i samme gruppe eller kolonne i det periodiske system har det samme antal valenselektroner og udviser lignende kemiske egenskaber.
4. Elektronisk konfiguration:Arrangementet af valenselektroner i de atomare orbitaler giver information om grundstoffets elektroniske konfiguration. Fordelingen af elektroner i forskellige energiniveauer og underniveauer hjælper kemikere med at forstå grundstoffets atomare struktur og adfærd.
5. Oxidationstal:Valenselektroner er også afgørende for at bestemme et grundstofs oxidationstilstande eller oxidationstal. Oxidationstal repræsenterer ladningen af et atom, når det taber eller får elektroner i en kemisk reaktion. Antallet af valenselektroner, der er tilgængelige for overførsel eller deling, påvirker oxidationstallene og grundstoffets overordnede kemiske reaktivitet.
6. Kemiske formler:Valenselektroner spiller en rolle ved bestemmelse af forbindelsers kemiske formler. Ved at overveje valenselektronerne af de reagerende grundstoffer og deres elektroniske konfigurationer kan kemikere forudsige forholdet mellem grundstofferne og danne forbindelser.
7. Lewis-strukturer:Valenselektroner er essentielle ved tegning af Lewis-strukturer, som repræsenterer arrangementet af elektroner omkring atomer i et molekyle. Lewis-strukturer giver en visuel repræsentation af bindingen mellem atomer baseret på deling eller overførsel af valenselektroner.
8. Bindingskapacitet:Antallet af valenselektroner bestemmer et grundstofs bindingskapacitet, som er det maksimale antal bindinger, det kan danne med andre atomer. Grundstoffer med et højere antal valenselektroner har en større bindingskapacitet og kan deltage i flere kemiske bindinger.
Ved at forstå valenselektronerne af forskellige grundstoffer kan kemikere forudsige og forklare deres kemiske adfærd, reaktivitet og bindingspræferencer, hvilket fører til udvikling og forståelse af forskellige kemiske forbindelser, reaktioner og materialer.
Sidste artikelHvad er pH-værdien af 10,0L 0,0020 M HCL?
Næste artikelHvad er de fleste af grundstofferne i det periodiske system?
 Varme artikler
Varme artikler
-
 Video:Hund vs. maskine:Hvem er en bedre bombedetektor?Kredit:The American Chemical Society Hvad er bedre til at finde en skjult bombe - en hund eller en elektronisk kemikaliedetektor? I denne episode, Reaktionsholdet rejser til U.S. Naval Research L
Video:Hund vs. maskine:Hvem er en bedre bombedetektor?Kredit:The American Chemical Society Hvad er bedre til at finde en skjult bombe - en hund eller en elektronisk kemikaliedetektor? I denne episode, Reaktionsholdet rejser til U.S. Naval Research L -
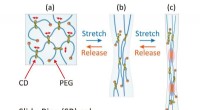 Biokompatible hydrogelmaterialer kan hurtigt komme sig efter mekanisk belastningEn strain gauge trækker prøver af hydrogel fra hinanden. (Øvre) En typisk gel med et hak skåret i venstre side snappede kort tid efter at den var strakt. (Midt) Den nye selvforstærkede gel havde et ha
Biokompatible hydrogelmaterialer kan hurtigt komme sig efter mekanisk belastningEn strain gauge trækker prøver af hydrogel fra hinanden. (Øvre) En typisk gel med et hak skåret i venstre side snappede kort tid efter at den var strakt. (Midt) Den nye selvforstærkede gel havde et ha -
 Designer peptider viser potentiale til at blokere vira, tilskynde til fremtidige studierKredit:Rensselaer Polytekniske Institut Kemisk fremstillede peptider, designet og udviklet af et team af forskere ved Rensselaer Polytechnic Institute, kunne vise sig at være værdifuld i kampen mo
Designer peptider viser potentiale til at blokere vira, tilskynde til fremtidige studierKredit:Rensselaer Polytekniske Institut Kemisk fremstillede peptider, designet og udviklet af et team af forskere ved Rensselaer Polytechnic Institute, kunne vise sig at være værdifuld i kampen mo -
 En fantastisk ny måde at male 3D-printede objekter påEt hydrogelgitter uden (venstre) og med (højre) belægning. Kredit:Jonathan P. Singer/Rutgers University-New Brunswick. Rutgers ingeniører har skabt en yderst effektiv måde at male komplekse 3-D-pr
En fantastisk ny måde at male 3D-printede objekter påEt hydrogelgitter uden (venstre) og med (højre) belægning. Kredit:Jonathan P. Singer/Rutgers University-New Brunswick. Rutgers ingeniører har skabt en yderst effektiv måde at male komplekse 3-D-pr


