Hvad er massen af 5,23x1021 platinatomer?
Først skal vi finde antallet af mol platin i 5,23x1021 atomer. Det kan vi gøre ved at dividere antallet af atomer med Avogadros tal, som er 6,022x1023 atomer/mol:
$$mol \ af \ Pt =\frac{5,23\times10^{21} \ atoms}{6,022\times10^{23} \ atomer/mol} =8,68\times10^{-3} \ mol$$
Nu kan vi bruge platinets molære masse til at beregne massen af 5,23x1021 platinatomer ved at gange antallet af mol med molmassen:
$$masse \ af \ Pt =8,68\times10^{-3} \ mol \times 195,084 \ g/mol =1,70 \ g$$
Derfor er massen af 5,23x1021 platinatomer 1,70 gram.
Sidste artikelHvad er hovedkilden til kuldioxid?
Næste artikelHvordan kan du kende forskel på en zink- og bronzepenning?
 Varme artikler
Varme artikler
-
 Video:Hvorfor smider vi gødning på skovbrande?Kredit:The American Chemical Society Når skovbrande udbryder på varme, blæsende dage, de udgør en alvorlig trussel mod mennesker og miljø. Denne uge om reaktioner, Lær, hvordan brandmænd bruger g
Video:Hvorfor smider vi gødning på skovbrande?Kredit:The American Chemical Society Når skovbrande udbryder på varme, blæsende dage, de udgør en alvorlig trussel mod mennesker og miljø. Denne uge om reaktioner, Lær, hvordan brandmænd bruger g -
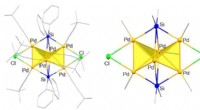 Sommerfugleformet palladium subnano-klynge bygget i 3-DHele (venstre) og kernestrukturen (højre) af 3-D klyngemolekyle baseret på palladium. Kredit:2019 Yusuke Sunada, Institut for Industrividenskab, Universitetet i Tokyo Miniaturisering er fremskridt
Sommerfugleformet palladium subnano-klynge bygget i 3-DHele (venstre) og kernestrukturen (højre) af 3-D klyngemolekyle baseret på palladium. Kredit:2019 Yusuke Sunada, Institut for Industrividenskab, Universitetet i Tokyo Miniaturisering er fremskridt -
 Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no
Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no -
 Forskere opdager en spænding, der afhænger af bølgelængden af indfaldende lysSbSI og SbSI:Sb2 S3 fotovoltaiske apparater. Kredit:Ryosuke Nishikubo Forskere fra Institute for Open and Transdisciplinary Research Initiatives ved Osaka University opdagede en ny funktion af solc
Forskere opdager en spænding, der afhænger af bølgelængden af indfaldende lysSbSI og SbSI:Sb2 S3 fotovoltaiske apparater. Kredit:Ryosuke Nishikubo Forskere fra Institute for Open and Transdisciplinary Research Initiatives ved Osaka University opdagede en ny funktion af solc
- Hvorfor din kat gør disse 6 ting, ifølge videnskaben
- Kunne saudisk olie forhindre en klimaaftale i Paris?
- Ny miljøindikator til evaluering af produkters positive klimapåvirkninger
- Hvordan interaktion med hunner øger aggression hos hanfrugtfluer
- Ny software gør mobiltelefontilbehør til åndedrætsmonitor
- Forskere vurderer veje mod at opretholde BC caribou, indtil habitat genoprettes


