Hvordan forårsager hydrogenbinding viskositet?
Jo stærkere hydrogenbindingerne er, jo mere tyktflydende vil væsken være. For eksempel er vand en relativt tyktflydende væske på grund af de stærke hydrogenbindinger mellem vandmolekyler. I modsætning hertil er ethanol en mindre viskøs væske, fordi hydrogenbindingerne mellem ethanolmolekyler er svagere.
En væskes viskositet afhænger også af dens temperatur. Når temperaturen på en væske stiger, øges molekylernes kinetiske energi, hvilket får dem til at bevæge sig hurtigere og bryde brintbindingerne fra hinanden. Dette resulterer i et fald i viskositeten.
For eksempel er vand mere tyktflydende ved stuetemperatur, end det er ved højere temperaturer. Dette skyldes, at brintbindingerne mellem vandmolekyler er stærkere ved stuetemperatur, hvilket får væsken til at flyde langsommere.
Sidste artikelHvilken faktor er vigtigst for at bestemme, om vand er en fast væske eller gas?
Næste artikelHvad opløser salt hurtigere?
 Varme artikler
Varme artikler
-
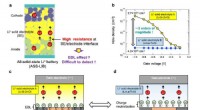 Ny måde at undersøge den elektriske dobbeltlagseffekt på(a) Diagram over et hel-solid-state Li-ion batteri, der lider af høj grænseflademodstand, formodes at skyldes EDL-effekten. (b) Diamantbaserede felteffekttransistorer (FETer) lader os modulere huldens
Ny måde at undersøge den elektriske dobbeltlagseffekt på(a) Diagram over et hel-solid-state Li-ion batteri, der lider af høj grænseflademodstand, formodes at skyldes EDL-effekten. (b) Diamantbaserede felteffekttransistorer (FETer) lader os modulere huldens -
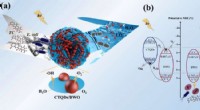 Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo
Forskere udvikler Z-skema katalysator for forurenende stoffer i vandSkematisk illustration af fotokatalytisk mekanisme. Kredit:YANG Pengqi I de seneste år, den hurtige industrialisering har forårsaget stadig mere alvorlig miljøforurening. Antibiotika og mikrobiolo -
 Ny kemi gør forbedringer af magiske lægemidler lettereKredit:CC0 Public Domain I det sidste årti, videnskabsfolk opdagede en finurlighed af lægemiddelkemi:Hvis du tilføjer et enkelt stof med en enkelt kulstof til en medicin, det kan gøre lægemidlet m
Ny kemi gør forbedringer af magiske lægemidler lettereKredit:CC0 Public Domain I det sidste årti, videnskabsfolk opdagede en finurlighed af lægemiddelkemi:Hvis du tilføjer et enkelt stof med en enkelt kulstof til en medicin, det kan gøre lægemidlet m -
 Robotkemiker opdager nye molekyler og reaktionerKredit:CC0 Public Domain En ny type kunstig intelligens-drevet kemi kan revolutionere måden molekyler opdages på, forskere hævder. I et nyt papir offentliggjort i dag i tidsskriftet Natur , kem
Robotkemiker opdager nye molekyler og reaktionerKredit:CC0 Public Domain En ny type kunstig intelligens-drevet kemi kan revolutionere måden molekyler opdages på, forskere hævder. I et nyt papir offentliggjort i dag i tidsskriftet Natur , kem


