Kemisk reaktion af ammoniak og HCl?
NH$_3$ + HCl → NH$_4$Cl
I denne reaktion fungerer ammoniak som en base, der accepterer en proton (H$^+$) fra saltsyre, der fungerer som en syre. Protonen fra HCl kombineres med det enlige elektronpar på nitrogenatomet i ammoniak og danner ammoniumionen (NH$_4^+$). Chloridionen (Cl$^-$) fra HCl kombineres med ammoniumionen og danner ammoniumchlorid, et hvidt, krystallinsk fast stof.
Reaktionen mellem ammoniak og saltsyre udføres typisk i vandige opløsninger. Reaktionsprodukterne, ammoniumchlorid og vand, er begge opløselige i vand og forbliver opløst i opløsningen. Reaktionen er eksoterm, hvilket betyder, at den frigiver varme. Den varme, der produceres under reaktionen, er med til at drive reaktionen fremad og resulterer i en hurtig og fuldstændig omdannelse af reaktanterne til produkter.
Reaktionen mellem ammoniak og saltsyre er en vigtig kemisk proces med flere industrielle anvendelser. Det bruges til fremstilling af gødning, såsom ammoniumnitrat og ammoniumsulfat, som er afgørende for landbruget. Det bruges også til fremstilling af lægemidler, farvestoffer og andre kemikalier. Derudover udnyttes reaktionen i spildevandsrensningsanlæg til at neutralisere surt spildevand og fjerne ammoniak, som kan være skadeligt for vandlevende organismer.
Sidste artikelHvad er opløsningsmidlet af sprite?
Næste artikelHvad er vægtprocenten af saltsyre?
 Varme artikler
Varme artikler
-
 Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr
Design af hierarkiske nanoporøse membraner til højeffektive adsorptions- og opbevaringsapplikation…Fotografier af de hierarkiske nanoporøse membraner, der er skabt ved hjælp af en coatingbladsmetode. EN, Fotografi af stort område HNM (10 × 10 cm2) fremstillet ved en rakel-metode. B, Fotografi af fr -
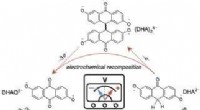 Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig
Forskning forlænger levetiden for molekyler i organiske flow-batterier til praktiske værdierFlowbatteriets cyklus. Når molekylet nedbrydes under regelmæssig cykling, kan det genoplives ved, at det skaber en spændingsimpuls, der nulstiller de nedbrydende molekyler tilbage til deres oprindelig -
 Sådan får du ledende geler til at klæbe, når de er våde(A) Billede af en lap-shear test opsætning. Billedkredit:Hyunwoo Yuk, MIT. (B) Billede af klæbemiddelsvigt under en lap-shear test af en våd PEDOT:PSS klæbet på et uberørt glas eller et uberørt glas m
Sådan får du ledende geler til at klæbe, når de er våde(A) Billede af en lap-shear test opsætning. Billedkredit:Hyunwoo Yuk, MIT. (B) Billede af klæbemiddelsvigt under en lap-shear test af en våd PEDOT:PSS klæbet på et uberørt glas eller et uberørt glas m -
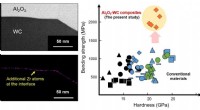 Brug af zirconium som tilsætningsstof i superstærke kompositmaterialerForskere ved Nagoya Universitet, arbejder i samarbejde med NGK Spark Plug Co., Ltd., har udviklet et sæt kompositmaterialer sammensat af lag af aluminiumoxid (Al2O3) og wolframcarbid (WC) med zirconiu
Brug af zirconium som tilsætningsstof i superstærke kompositmaterialerForskere ved Nagoya Universitet, arbejder i samarbejde med NGK Spark Plug Co., Ltd., har udviklet et sæt kompositmaterialer sammensat af lag af aluminiumoxid (Al2O3) og wolframcarbid (WC) med zirconiu
- Hvordan Stephen Hawking arbejdede
- Proces til overgang af to-lags grafen til diamanthårdt materiale ved stød opdaget
- At bygge en månebase er en stor opgave, men disse små satellitter vil bane vejen
- Leica genopliver det ikoniske sovjetiske Zenit-kamera
- Forskerhold designer små kemiske næser
- Meget højenergi gammastråleemission detekteret fra blazar TXS 1515-273


