Hvordan 1 molal urinstofopløsning er lig med 0,5 NaCl-opløsning?
Her er forklaringen:
1. Molalitet vs. Molaritet
- Molalitet (m) er defineret som antallet af mol opløst stof pr. kilogram _opløsningsmiddel_.
- Molaritet (M) er defineret som antallet af mol opløst stof pr. liter _opløsning_.
2. Beregninger
- Lad os overveje 1 kg opløsningsmiddel (vand) til begge opløsninger.
- 1 molal urinstofopløsning:
- Molær masse af urinstof (CH4N₂O) =60 g/mol
- 1 molal opløsning betyder, at der er 1 mol urinstof opløst i 1 kg vand.
Derfor indeholder 1 molal ureaopløsning 60 gram urea i 1 kg vand.
- 0,5 NaCl opløsning:
- Molær masse af NaCl (natriumchlorid) =58,45 g/mol
- En 0,5 M NaCl-opløsning betyder, at der er 0,5 mol NaCl opløst i 1 liter opløsning. For at finde massen af NaCl i 1 kg vand:
Masse af NaCl =(0,5 mol) x (58,45 g/mol) =29,225 gram
Derfor indeholder en 0,5 M NaCl-opløsning 29,23 gram NaCl i 1 kg vand.
3. Sammenligning
- Massen af urinstof i en 1 molal urinstofopløsning (60 gram) er forskellig fra massen af NaCl i en 0,5 M NaCl-opløsning (29,23 gram), når begge opløsninger fremstilles med 1 kg vand.
- Derfor er 1 molal urinstofopløsning _ikke lig_ med 0,5 M NaCl-opløsning med hensyn til koncentration eller sammensætning.
Sidste artikelHvilke ændringer finder sted, når et stof gennemgår faseskift?
Næste artikelhvad er 2 skeletkemiske ligninger?
 Varme artikler
Varme artikler
-
 Forskere opnår 4-D trykt materialeForskerne printede deres silikone-baserede prøver ved hjælp af en direkte blæk-skriveproces. Det sammensatte blækmateriale blev ekstruderet ved stuetemperatur fra printerens dyse for at danne træbunke
Forskere opnår 4-D trykt materialeForskerne printede deres silikone-baserede prøver ved hjælp af en direkte blæk-skriveproces. Det sammensatte blækmateriale blev ekstruderet ved stuetemperatur fra printerens dyse for at danne træbunke -
 Ny opdagelse åbner en ny vej for høj-titerproduktion af drop-in biobrændstofferLaboratorieopsætningen af lysinkubatoren viser to forskellige eksperimentelle blå lysopsætninger. Kredit:Jingbo Li, MIT Et særligt lysafhængigt enzym, som først blev opdaget for omkring tre år s
Ny opdagelse åbner en ny vej for høj-titerproduktion af drop-in biobrændstofferLaboratorieopsætningen af lysinkubatoren viser to forskellige eksperimentelle blå lysopsætninger. Kredit:Jingbo Li, MIT Et særligt lysafhængigt enzym, som først blev opdaget for omkring tre år s -
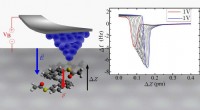 Demonstration af et enkelt molekyle piezoelektrisk effektDen omvendte piezoelektriske effekt i enkelte heptahelicen-afledte molekyler. Kredit:Pavel Jelínek / Institut for Fysik i CAS Forskere fra Institut for Organisk Kemi og Biokemi i CAS (IOCB Prag) o
Demonstration af et enkelt molekyle piezoelektrisk effektDen omvendte piezoelektriske effekt i enkelte heptahelicen-afledte molekyler. Kredit:Pavel Jelínek / Institut for Fysik i CAS Forskere fra Institut for Organisk Kemi og Biokemi i CAS (IOCB Prag) o -
 Behøvede det tidlige liv lang tid, komplekse molekyler til at lave cellelignende rum?Membranløse rum lavet af korte polymerer (10 enheder lang polymer af asparaginsyre og 10 enheder lang lysin). Lysfeltbillede (venstre) og fluorescerende billede (højre), der viser fluorescerende mærke
Behøvede det tidlige liv lang tid, komplekse molekyler til at lave cellelignende rum?Membranløse rum lavet af korte polymerer (10 enheder lang polymer af asparaginsyre og 10 enheder lang lysin). Lysfeltbillede (venstre) og fluorescerende billede (højre), der viser fluorescerende mærke
- Fysikere modellerer supernovaerne, der er et resultat af pulserende supergiganter som Betelgeuse
- Arkæologer finder sølvskat på den tyske østersøø
- Universers ultraviolette baggrund kunne give spor om manglende galakser
- Genopretning af Brasiliens Spixs-ara, populær i Rio-animerede film, truet af klimaændringer
- Hvorfor er meiose vigtig i en organisme?
- Sætter et nyt spin på Majorana fermioner


