Hvilke ændringer finder sted, når et stof gennemgår faseskift?
1. Fast til flydende (smeltende) :
- Stoffet optager energi i form af varme.
- Stoffets partikler får kinetisk energi og begynder at vibrere kraftigere.
- Tiltrækningskræfterne mellem partiklerne svækkes, så de kan bevæge sig mere frit.
- Stoffet skifter fra en stiv og veldefineret form (fast) til en flydende og ikke-stiv form (flydende).
- Stoffets volumen udvider sig normalt lidt på grund af øget molekylær bevægelse.
- Smeltepunktet er den specifikke temperatur, ved hvilken et stof skifter fra fast til flydende tilstand.
2. Væske til gas (fordampning) :
- Stoffet optager løbende energi i form af varme.
- Stoffets partikler får endnu mere kinetisk energi, hvilket øger deres hastighed og vibrationsbevægelse.
- Tiltrækningskræfterne mellem partiklerne bliver ubetydelige, så de kan bevæge sig uafhængigt.
- Stoffet ændres fra en væske med et bestemt volumen til en gas, der udvider sig for at fylde sin beholder.
- Stoffets volumen stiger markant i takt med, at partiklerne bevæger sig længere fra hinanden.
- Kogepunktet er den specifikke temperatur, ved hvilken en væske under et givet tryk ændres til en gasform.
3. Gas til væske (kondensering) :
- Stoffet mister energi i form af varme til omgivelserne.
- Gaspartiklerne bremser og mister kinetisk energi, hvilket resulterer i nedsat molekylær bevægelse.
- Tiltrækningskræfter mellem partiklerne bliver stærkere, hvilket får dem til at komme tættere på hinanden.
- Gassen omdannes til en væske, da partiklerne kondenserer til en mere kompakt form.
- Stoffets volumen falder betydeligt i forhold til dets gasformige tilstand.
- Kondensationspunktet er den temperatur, ved hvilken en gas omdannes til en væske under et bestemt tryk.
4. Fast til gas (sublimering) :
- Dette sker, når et fast stof direkte omdannes til en gas uden at passere gennem den flydende tilstand.
- De faste partikler absorberer energi, får kinetisk energi og overvinder tiltrækningskræfterne mellem dem.
- Sublimering sker ved temperaturer og tryk under et stofs tredobbelte punkt, hvor de tre faser (fast, flydende og gas) kan eksistere side om side.
- Stoffer, der let sublimerer, kaldes flygtige, såsom tøris (fast kuldioxid).
5. Væske til fast (frysning) :
- Det omvendte af smeltning, hvor en væske mister energi i form af varme til omgivelserne.
- De flydende partikler bremser, mister kinetisk energi og bliver mere ordnede.
- Tiltrækningskræfter mellem partiklerne forstærkes, hvilket får dem til at danne en stiv struktur.
- Stoffet går fra en væske med en bestemt form til et fast stof med en fast form og volumen.
- Frysepunktet er den temperatur, hvor en væske omdannes til et fast stof under et bestemt tryk.
Det er vigtigt at bemærke, at disse faseændringer kan påvirkes af faktorer som temperatur, tryk og intermolekylære kræfter i stoffet. Forskellige stoffer har forskellige faseændringstemperaturer, og nogle kan gennemgå disse overgange med forskellige hastigheder.
 Varme artikler
Varme artikler
-
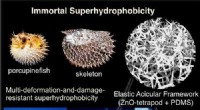 Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse
Porcupinefish inspirerer robust superhydrofobt materialeKredit:American Chemical Society Naturen har udviklet et blændende udvalg af materialer, der hjælper organismer med at trives i forskellige levesteder. Sommetider, videnskabsmænd kan udnytte disse -
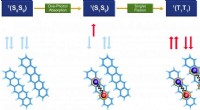 Banebrydende kvantekemiteknik til beregningsdesign og optimering af organiske fotofunktionelle mater…Billede 1. Singlet-fissionsprocessen i pentacen-dimer:den indledende singlet-exciton S1S0 af en monomer deler sig i to frie triplet-excitoner T1-T1 via et korreleret triplet-par 1 (TT) ligeligt fordel
Banebrydende kvantekemiteknik til beregningsdesign og optimering af organiske fotofunktionelle mater…Billede 1. Singlet-fissionsprocessen i pentacen-dimer:den indledende singlet-exciton S1S0 af en monomer deler sig i to frie triplet-excitoner T1-T1 via et korreleret triplet-par 1 (TT) ligeligt fordel -
 Fremstilling af jetbrændstof af kuldioxidKredit:Unsplash/CC0 Public Domain Et team af forskere tilknyttet adskillige institutioner i Storbritannien og en i Saudi-Arabien har udviklet en måde at producere flybrændstof ved at bruge kuldiox
Fremstilling af jetbrændstof af kuldioxidKredit:Unsplash/CC0 Public Domain Et team af forskere tilknyttet adskillige institutioner i Storbritannien og en i Saudi-Arabien har udviklet en måde at producere flybrændstof ved at bruge kuldiox -
 Opdagelse fører til ny lagring af fløde og kyllingefoderKredit:Leiden University Hvad har en ny anti-aging ingrediens til kosmetik og en ny type kyllingefoder tilfælles? De blev begge fremstillet ved hjælp af et nyt opløsningsmiddel udviklet af Leiden
Opdagelse fører til ny lagring af fløde og kyllingefoderKredit:Leiden University Hvad har en ny anti-aging ingrediens til kosmetik og en ny type kyllingefoder tilfælles? De blev begge fremstillet ved hjælp af et nyt opløsningsmiddel udviklet af Leiden


