Hvad er basiciteten af syrer?
Basiciteten eller alkaliniteten af en syre er et mål for dens evne til at donere protoner (H+ ioner). Selvom stærke syrer producerer høje koncentrationer af H+, er dette ikke alene et mål for deres basicitet.
Basiciteten af en syre bestemmes af:
- Stabilitet af dens konjugerede base - syrer, der giver stabile konjugerede baser, er svage syrer.
- Ladning på den konjugerede base - konjugerede baser med højere ladning er generelt svagere baser end neutrale konjugerede baser.
- Antal sure protoner - syrer, der kan donere mere end én proton pr. molekyle, kaldet polyprotiske syrer, er generelt mere sure end monoprotiske syrer.
For eksempel har HCl en meget stærk konjugeret base, Cl-, som er meget stabil. Derimod har HF en svag konjugeret base, F-, som er relativt ustabil, fordi den er en lille, meget elektronegativ ion med den høje hydreringsenergi. HCl er derfor en stærkere syre end HF.
På samme måde er den polyprotiske syre H2SO4 en stærkere syre end den monoprotiske syre HCl, fordi den kan donere mere end én proton. Den første proton af H2SO4 dissocierer og danner H+ og HSO4-, hvor HSO4-ionen er en relativt svag base. Den anden proton af H2SO4 er mere sur, fordi den konjugerede base SO42- er en svagere base end HSO4-.
Syrernes basicitet kan måles ved deres pKa-værdier, som repræsenterer den negative logaritmiske værdi af deres syredissociationskonstant (Ka). Jo lavere pKa, jo stærkere syren.
For eksempel har HCl en meget lav pKa (-7), hvilket betyder, at den er fuldstændig dissocieret i vand og har en stærk konjugeret base.
I modsætning hertil har HF en meget højere pKa (3,17), hvilket indikerer, at den kun dissocierer i begrænset omfang og har en svag konjugeret base.
En højere basicitet betyder, at en syre kan donere en proton (H+) til en stærkere base. Syrer, der kan donere flere protoner, kaldes polyprotiske syrer. Basiciteten af en syre afhænger af styrken af den konjugatbase.
- Stærke syrer har svage konjugerede baser.
- Svage syrer har stærke konjugerede baser.
Følgende er nogle eksempler på stærke og svage syrer:
| Stærke syrer | Svage syrer |
|---|---|
| HCl | HCN |
| H2SO4 | HF |
| HNO3 | H2CO3 |
| HClO4 | CH3COOH |
Styrken eller svagheden af en syre påvirkes også af opløsningsmidlet. For eksempel er HCl en stærk syre i vand, men er en svag syre i ethanol.
Sidste artikel0,2 M natriumphosphatbuffer pH 7,0?
Næste artikelEksempler på syrer, der er dibasiske?
 Varme artikler
Varme artikler
-
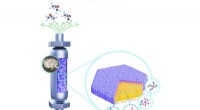 Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de
Bindemiddelfri MWW-type titanosilikat til selektiv og holdbar propylenepoxideringForskere designet og forberedte en struktureret bindemiddelfri Ti-MWW katalysator via en kombinationsmetode til formning, omkrystallisation og kemisk modifikation af aktive Ti-steder. Som resultat, de -
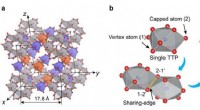 Gennembrud mod løsning af glasets strukturelle mysterium(a) Røde kugler er Pd- og Ni -atomer, hvorimod de blå kugler repræsenterer P -atomer. Den orangefarvede polyeder repræsenterer den Pd-berigede lille klynge, og det blåfarvede polyeder repræsenterer de
Gennembrud mod løsning af glasets strukturelle mysterium(a) Røde kugler er Pd- og Ni -atomer, hvorimod de blå kugler repræsenterer P -atomer. Den orangefarvede polyeder repræsenterer den Pd-berigede lille klynge, og det blåfarvede polyeder repræsenterer de -
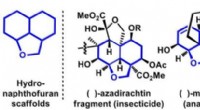 Vigtige tricykliske kemiske forbindelser med effektiv chiralitetskontrolFigur 1. Repræsentative eksempler på bioaktive molekyler med hydronaphthofurans stilladser. Kredit:Osaka University Osaka University-forskere udviklede en meget effektiv måde at producere chirale
Vigtige tricykliske kemiske forbindelser med effektiv chiralitetskontrolFigur 1. Repræsentative eksempler på bioaktive molekyler med hydronaphthofurans stilladser. Kredit:Osaka University Osaka University-forskere udviklede en meget effektiv måde at producere chirale -
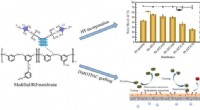 Ny teknologi til forbedring af RO-membraners høje permselektivitet og anti-biobegroningsegenskaberKredit:Xinxia Tian et al. Omvendt osmose (RO) har tiltrukket bred opmærksomhed for sin omfattende anvendelighed i brakvand og afsaltning af havvand. Tyndfilmskomposit (TFC) polyamid (PA) RO-membran
Ny teknologi til forbedring af RO-membraners høje permselektivitet og anti-biobegroningsegenskaberKredit:Xinxia Tian et al. Omvendt osmose (RO) har tiltrukket bred opmærksomhed for sin omfattende anvendelighed i brakvand og afsaltning af havvand. Tyndfilmskomposit (TFC) polyamid (PA) RO-membran
- Seneste version af klimasystemmodellen viser bedre ydeevne i simulering
- Empirisk formel for en forbindelse indeholdende 60,3 procent magnesium og 39,7 oxygen?
- Model identificerer en høj grad af udsving i gluoner som afgørende for at forklare protonstrukture…
- Billede af højeksplosive detonatorer
- Hvad sker der, hvis du spiser muggent brød?
- Et nyt twist i kiral topologi


