Hvad er det begrænsende reagens, når 150,0 g nitrogen reagerer med 32,1 g brint?
$$N_2 + 3H_2 \højrepil 2NH_3$$
For at bestemme det begrænsende reagens skal vi beregne antallet af mol af hver reaktant og sammenligne dem med det støkiometriske forhold i den afbalancerede ligning.
1. Beregn antallet af mol nitrogen:
Mol nitrogen =masse / molær masse
Mol nitrogen =150,0 g / 28,01 g/mol =5,35 mol
2. Beregn antallet af mol brint:
Mol brint =masse / molær masse
Mol hydrogen =32,1 g / 2,016 g/mol =15,9 mol
3. Sammenlign antallet af mol af hver reaktant med det støkiometriske forhold:
Ifølge den afbalancerede ligning reagerer 1 mol nitrogen med 3 mol brint. Derfor er det støkiometriske forhold mellem nitrogen og brint 1:3.
- For nitrogen:5,35 mol / 1 =5,35
- For brint:15,9 mol / 3 =5,3
4. Bestem det begrænsende reagens:
Det begrænsende reagens er reaktanten, der er til stede i et mindre molforhold sammenlignet med det støkiometriske forhold. I dette tilfælde har både nitrogen og brint det samme molforhold på 5,35. Derfor er der ingen begrænsende reagens. Det betyder, at både nitrogen og brint vil blive fuldstændig forbrugt i reaktionen, og reaktionen vil gå til afslutning.
 Varme artikler
Varme artikler
-
 Overfladeteknik får rødt lysPassivering af overfladen af perovskit nanokrystaller med IDA-molekyler forbedrer deres stabilitet og deres optiske og elektriske egenskaber, gør dem nyttige til optoelektroniske enheder. Kredit:KAU
Overfladeteknik får rødt lysPassivering af overfladen af perovskit nanokrystaller med IDA-molekyler forbedrer deres stabilitet og deres optiske og elektriske egenskaber, gør dem nyttige til optoelektroniske enheder. Kredit:KAU -
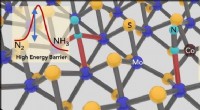 Ammoniaksyntese gjort let med 2-D katalysatorTilsætning af koboltatomer til fyldning af ledige pladser i 2D molybdendisulfidkrystaller øger materialets evne til at katalysere ammoniak fra dinitrogen. Forskere fra Rice University har udviklet en
Ammoniaksyntese gjort let med 2-D katalysatorTilsætning af koboltatomer til fyldning af ledige pladser i 2D molybdendisulfidkrystaller øger materialets evne til at katalysere ammoniak fra dinitrogen. Forskere fra Rice University har udviklet en -
 Forskere sætter et nyt spin på molekylær oxygen(a-c) AFM-billeder før (a) og efter (b) KPFS-manipulation af O annonce 2− −O annonce 2− med spidsen placeret symmetrisk i midten og de tilsvarende linjeprofiler (c). Det dobbelte lyspunkt blev
Forskere sætter et nyt spin på molekylær oxygen(a-c) AFM-billeder før (a) og efter (b) KPFS-manipulation af O annonce 2− −O annonce 2− med spidsen placeret symmetrisk i midten og de tilsvarende linjeprofiler (c). Det dobbelte lyspunkt blev -
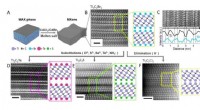 En ny strategi til syntetisering af 2-D uorganiske materialer, der bruges i kondensatorer, batterier…Overfladereaktioner af MXener i smeltede uorganiske salte. (A) Skemaer for ætsning af MAX faser i Lewis sure smeltede salte. (B) Atomisk opløsning højvinklet ringformet mørkt felt (HAADF) billede af T
En ny strategi til syntetisering af 2-D uorganiske materialer, der bruges i kondensatorer, batterier…Overfladereaktioner af MXener i smeltede uorganiske salte. (A) Skemaer for ætsning af MAX faser i Lewis sure smeltede salte. (B) Atomisk opløsning højvinklet ringformet mørkt felt (HAADF) billede af T
- Billede:Eclipse 2017 umbra set fra rummet
- Hvorfor er helixen så populær en form?
- Kepler løser mysteriet med hurtige og rasende eksplosioner
- NA61/SHINE giver neutrino -eksperimenter en hjælpende hånd
- Kunne mini-Neptunes være bestrålede havplaneter?
- Australien er ved at vedtage omfattende cyberlove på trods af teknologigigantens frygt


