Hvad har natriumhydroxid en høj opløselighed i vand?
* Ionisk forbindelse :Natriumhydroxid (NaOH) er en ionisk forbindelse sammensat af positivt ladede natrium (Na+) ioner og negativt ladede hydroxid (OH-) ioner.
* Polære vandmolekyler :Vand er et polært molekyle, hvilket betyder, at det har en let positiv ladning i den ene ende (brintatomerne) og en svag negativ ladning i den anden ende (iltatomet).
* Attraktive kræfter :Når natriumhydroxid opløses i vand, tiltrækkes de positive natriumioner til de negative iltatomer i vand, mens de negative hydroxidioner tiltrækkes af vands positive hydrogenatomer. Disse tiltrækningskræfter mellem ionerne og vandmolekylerne kaldes elektrostatiske kræfter eller ion-dipol-interaktioner.
Stærk hydreringsenergi:
* Hydreringsskaller :De polære vandmolekyler omgiver og opløser natrium- og hydroxidionerne og danner hydreringsskaller omkring dem. De positivt ladede natriumioner er omgivet af en skal af negative oxygenatomer, mens de negativt ladede hydroxidioner er omgivet af en skal af positive hydrogenatomer.
* Hydrationsenergi :Den energi, der frigives, når ioner bliver omgivet af vandmolekyler, er kendt som hydreringsenergi. Natrium- og hydroxidioner har relativt høje hydreringsenergier, fordi de elektrostatiske vekselvirkninger mellem ionerne og vandmolekylerne er stærke. Den energi, der frigives under hydrering, overvinder gitterenergien (energi, der kræves for at adskille ionerne i den faste natriumhydroxidkrystal), hvilket tillader forbindelsen at opløses let i vand.
* Høj opløselighed :Kombinationen af natriumhydroxids polære natur og dets stærke hydreringsenergi resulterer i dets høje opløselighed i vand. De stærke elektrostatiske kræfter mellem ionerne og vandmolekylerne sikrer, at en betydelig mængde natriumhydroxid kan opløses i vand, før opløsningen bliver mættet.
Sammenfattende kan den høje opløselighed af natriumhydroxid i vand tilskrives den polære natur af forbindelsen, som muliggør stærke elektrostatiske interaktioner (ion-dipol-interaktioner) mellem dens ioner (Na+ og OH-) og vandmolekyler, hvilket fører til høj hydrering energi og i sidste ende resulterer i en høj grad af opløselighed.
 Varme artikler
Varme artikler
-
 Hvad er der bag ildelugtende vinKredit:CC0 Public Domain Aldring forbedrer ofte smagen af vin, men nogle gange kommer drikken frem fra opbevaring med en ubehagelig lugt. En af de primære syndere er svovlbrinte (H 2 S), som k
Hvad er der bag ildelugtende vinKredit:CC0 Public Domain Aldring forbedrer ofte smagen af vin, men nogle gange kommer drikken frem fra opbevaring med en ubehagelig lugt. En af de primære syndere er svovlbrinte (H 2 S), som k -
 Måling af ethanol dødelig tvillingKvinder i Indien sælger hjemmebrygget alkohol, som kan indeholde giftige mængder methanol. Kredit:Shutterstock / Steve Estvanik ETH-forskere har udviklet en billig, håndholdt måleapparat, der kan
Måling af ethanol dødelig tvillingKvinder i Indien sælger hjemmebrygget alkohol, som kan indeholde giftige mængder methanol. Kredit:Shutterstock / Steve Estvanik ETH-forskere har udviklet en billig, håndholdt måleapparat, der kan -
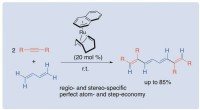 En effektiv tilgang til konjugerede tetraener fra butadien og alkynerEn ny one-pot tilgang af konjugerede tetraener fra 1, 3-butadien og to substituerede acetylener katalyseret af et nulvalent rutheniumkompleks. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo U
En effektiv tilgang til konjugerede tetraener fra butadien og alkynerEn ny one-pot tilgang af konjugerede tetraener fra 1, 3-butadien og to substituerede acetylener katalyseret af et nulvalent rutheniumkompleks. Kredit:Institut for Anvendt Kemi, Ingeniørskolen, Tokyo U -
 Nye bæredygtige pulpteknologierKredit:Alberto Masnovo, Shutterstock Visionen for papirmasse- og papirindustrien er at reducere udledningen af kuldioxid markant og samtidig forbedre energi- og ressourceeffektiviteten. Derfor,
Nye bæredygtige pulpteknologierKredit:Alberto Masnovo, Shutterstock Visionen for papirmasse- og papirindustrien er at reducere udledningen af kuldioxid markant og samtidig forbedre energi- og ressourceeffektiviteten. Derfor,


