Hvad skal du gøre for at bevise, at massen bevares under forbrændingsreaktioner?
1. Vælg et passende brændstof:
Vælg et brændstof, der gennemgår fuldstændig forbrænding, såsom metan (CH4) eller propan (C3H8). Disse brændstoffer reagerer med ilt for at producere kuldioxid (CO2) og vand (H2O).
2. Eksperimentel opsætning:
- Brug et lukket system, såsom en forseglet glasbeholder eller et forbrændingskammer, for at sikre, at der ikke går nogen masse tabt eller opnået under reaktionen.
- Anbring en kendt masse af brændstoffet inde i beholderen.
- Tilslut beholderen til en iltkilde eller brug en luftpumpe til at indføre en kontrolleret mængde luft.
3. Tænding:
Tænd brændstoffet ved hjælp af en gnist eller en anden antændelseskilde. Lad forbrændingsreaktionen fortsætte, indtil den er færdig.
4. Måling af produkter:
- Når reaktionen er afsluttet, måles massen af de resterende produkter inde i beholderen. Dette inkluderer massen af eventuelle faste rester (aske) og massen af selve beholderen.
- Saml de gasformige produkter, såsom CO2 og H2O, og bestem deres masse. Dette kan gøres ved at lede gasserne gennem en række fælder eller kondensatorer.
5. Massebalanceberegning:
- Beregn den samlede masse af produkterne (faste rester, gasformige produkter og beholder) og sammenlign den med brændstoffets begyndelsesmasse.
6. Bevarelse af messen:
- Hvis den samlede masse af produkterne er lig med brændstoffets begyndelsesmasse, viser det, at massen bevares under forbrændingen. Eventuelle uoverensstemmelser mellem den indledende og endelige masse indikerer potentielle fejl eller ufuldstændig forbrænding.
Ved omhyggeligt at kontrollere de eksperimentelle forhold, tage højde for alle produkter og udføre nøjagtige massemålinger, kan du fremlægge bevis for at understøtte bevarelsen af masse under forbrændingsreaktioner.
Sidste artikelHvad indikerer pH 7?
Næste artikelEr kaliumfluorid en ionbinding?
 Varme artikler
Varme artikler
-
 Enhed dirigerer sædcellerne til at gå imod strømmen for at hjælpe med infertilitetDen mikrofluidiske chip består af fire cylindriske kamre forbundet gennem mikrokanaler:væskeindløbskammeret, opsamlingskammeret, prøveindløbskammeret og affaldsopsamlingskammeret. Kredit:Florida Atlan
Enhed dirigerer sædcellerne til at gå imod strømmen for at hjælpe med infertilitetDen mikrofluidiske chip består af fire cylindriske kamre forbundet gennem mikrokanaler:væskeindløbskammeret, opsamlingskammeret, prøveindløbskammeret og affaldsopsamlingskammeret. Kredit:Florida Atlan -
 Levering af kræft-billeddannende isotoper af høj kvalitetPrototype væskesystem til zirconium-89 rensning. Billede taget gennem et varmecellevindue på Radiologisk Institut, University of Washington. Kredit:Matthew OHara, Pacific Northwest National Laboratory
Levering af kræft-billeddannende isotoper af høj kvalitetPrototype væskesystem til zirconium-89 rensning. Billede taget gennem et varmecellevindue på Radiologisk Institut, University of Washington. Kredit:Matthew OHara, Pacific Northwest National Laboratory -
 Forskere udvikler genbrug til kulfiberkompositterWashington State University professor Jinwen Zhang med sit forskergruppe for genbrug af kulfiber. Kredit:Washington State University Et WSU -forskerhold har for første gang udviklet en lovende måd
Forskere udvikler genbrug til kulfiberkompositterWashington State University professor Jinwen Zhang med sit forskergruppe for genbrug af kulfiber. Kredit:Washington State University Et WSU -forskerhold har for første gang udviklet en lovende måd -
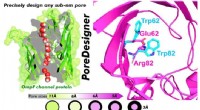 PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret
PoreDesigner forbedrer proteinkanaldesign til vandbehandling, bioseparationerFigur, der skitserer det grundlæggende i PoreDesigners arbejdsgang til ændring af porestørrelsen af et bakteriekanalprotein. Kredit:Manish Kumar / Penn State PoreDesigner, en fuldt automatiseret
- Sådan finder du en eksponentiel ligning med to point
- Forskning lægger grunden til ultratynde, energieffektiv fotodetektor på glas
- FORKLARER:Er New Orleans beskyttet mod en orkan?
- Hvad siger Polly? Samfundsvidenskabelige data afslører artsforskelle i vokalindlæring hos papegøj…
- Forskere viser, at en lovende fast elektrolyt er hydrofob
- Hvorfor fordøjer saltsyren produceret af maven sine egne foringsceller?


