Hvad er den største forskel mellem ioniske og kovalente bindinger?
Ioniske bindinger:
I ionbindinger overføres elektronparret fuldstændigt fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Den elektrostatiske tiltrækning mellem disse modsat ladede ioner holder den ioniske forbindelse sammen.
Karakteristika for ioniske bindinger:
- Indebærer en fuldstændig overførsel af elektroner.
- Medfører dannelse af ioner.
- Stærk elektrostatisk tiltrækning mellem ioner.
- Typisk dannet mellem et metal og et ikke-metal.
- Forbindelser er krystallinske faste stoffer ved stuetemperatur.
- Generelt opløseligt i polære opløsningsmidler som vand.
Kovalente bindinger:
I kovalente bindinger deles elektroner mellem atomer uden fuldstændig overførsel. Det delte elektronpar danner et område med høj elektrontæthed mellem de bundne atomer, hvilket skaber en stabil molekylær struktur.
Karakteristika for kovalente bindinger:
- Indebærer deling af elektronpar.
- Medfører ikke dannelse af ioner.
- Styrken afhænger af antallet af delte elektronpar.
- Typisk dannet mellem ikke-metaller.
- Kan være polær eller upolær afhængig af elektronegativitetsforskelle.
- Forbindelser kan eksistere som gasser, væsker eller faste stoffer ved stuetemperatur.
- Generelt uopløseligt i polære opløsningsmidler, men opløseligt i upolære opløsningsmidler.
 Varme artikler
Varme artikler
-
 Forøgelse af effektiviteten af kulstoffangst- og konverteringssystemerFarvestoffer bruges til at afsløre koncentrationen af kuldioxid i vandet. På venstre side er et gastiltrækkende materiale, og farvestoffet viser, at kuldioxiden forbliver koncentreret ved siden af
Forøgelse af effektiviteten af kulstoffangst- og konverteringssystemerFarvestoffer bruges til at afsløre koncentrationen af kuldioxid i vandet. På venstre side er et gastiltrækkende materiale, og farvestoffet viser, at kuldioxiden forbliver koncentreret ved siden af -
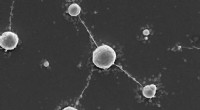 Wolfram som interstellar strålingsafskærmning?Wolfram polyoxometalater som livsopretholdende uorganiske rammer. Enkeltceller af M. sedula efter dyrkning med wolfram-bærende W-POM. Kredit:© Tetyana Milojevic Et kogepunkt på 5900 grader Celsius
Wolfram som interstellar strålingsafskærmning?Wolfram polyoxometalater som livsopretholdende uorganiske rammer. Enkeltceller af M. sedula efter dyrkning med wolfram-bærende W-POM. Kredit:© Tetyana Milojevic Et kogepunkt på 5900 grader Celsius -
 Silkefibre kan være højteknologiske naturlige metamaterialerNy forskning tyder på, at fibre fra en silkeorms kokon kan repræsentere naturlige metamaterialer, ”En opdagelse med forskellige teknologiske og videnskabelige implikationer. Kredit:Purdue University i
Silkefibre kan være højteknologiske naturlige metamaterialerNy forskning tyder på, at fibre fra en silkeorms kokon kan repræsentere naturlige metamaterialer, ”En opdagelse med forskellige teknologiske og videnskabelige implikationer. Kredit:Purdue University i -
 Vaccineingredienser kan gemme sig i små molekylebibliotekerForskerne fandt et molekyle, der kan bruges som vaccineadjuvans og styrker immunresponset, når det tilsættes en vaccine. Kredit:Mindy Takamiya/Kyoto University iCeMS Mange vacciner indeholder ingr
Vaccineingredienser kan gemme sig i små molekylebibliotekerForskerne fandt et molekyle, der kan bruges som vaccineadjuvans og styrker immunresponset, når det tilsættes en vaccine. Kredit:Mindy Takamiya/Kyoto University iCeMS Mange vacciner indeholder ingr
- Hjemmelavet generator Science Project
- Bedre chokolade med mobilteknologi
- Røde Kors 'websted hacket i det seneste cyberangreb i Singapore
- Sådan skriver du en ligning med absolut værdi, der har givet løsninger <p> <p> Du kan angive den …
- Forskere bruger tobaksaffaldsvæske og jernrester til fjernelse af Cd(II)
- Ny undersøgelse giver beviser for årtier gammel teori til at forklare vandets ulige adfærd


