Hvad sker der, når natriumsulfat blandes med vand?
Her er hvad der sker, når natriumsulfat blandes med vand:
1. Interaktion mellem opløsningsmiddel og opløsningsmiddel: Natriumsulfat, det opløste stof, interagerer med vandmolekyler, opløsningsmidlet. De polære vandmolekyler tiltrækkes af de ladede ioner af natriumsulfat.
2. Dissociation: Natriumsulfat dissocieres til sine respektive ioner i vand. Der dannes natriumioner (Na+) og sulfationer (SO4^2-).
3. Hydrering: Vandmolekyler omgiver og hydrerer de individuelle ioner og danner hydreringsskaller. Denne proces stabiliserer ionerne i opløsningen.
4. Danning af en homogen blanding: Natriumsulfatmolekyler bryder op i individuelle ioner og bliver jævnt fordelt i vandet. Dette resulterer i dannelsen af en homogen blanding, hvor det opløste stof (natriumsulfat-ioner) er ensartet fordelt i opløsningsmidlet (vand).
Omfanget af opløsning afhænger af forskellige faktorer såsom temperatur, koncentration og tilstedeværelsen af andre opløste stoffer. Når temperaturen stiger, stiger opløseligheden af natriumsulfat generelt. Koncentrationen af opløsningen spiller også en rolle, da højere koncentrationer kan nå det mætningspunkt, hvor ikke mere opløst stof kan opløses. Tilstedeværelsen af andre opløste stoffer kan påvirke opløseligheden gennem interaktioner og konkurrence om vandmolekyler.
Samlet set fører blanding af natriumsulfat med vand til opløsning af saltet, hvilket resulterer i dannelsen af en klar, homogen opløsning indeholdende natrium- og sulfationer omgivet af vandmolekyler.
 Varme artikler
Varme artikler
-
 Et nyt materiale til gennemsigtige og fleksible displaysFigur 1. En TFT-enhed fremstillet på poly (amid-imid) film:A) Skematisk struktur af den transparente og fleksible IGZO TFT fremstillet på PAI (s-u). B) Elektriske egenskaber og C) transmittansspektre
Et nyt materiale til gennemsigtige og fleksible displaysFigur 1. En TFT-enhed fremstillet på poly (amid-imid) film:A) Skematisk struktur af den transparente og fleksible IGZO TFT fremstillet på PAI (s-u). B) Elektriske egenskaber og C) transmittansspektre -
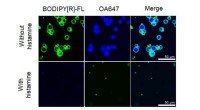 Syntetiserer kemisk-sansende celler fra bundenEn undersøgelse offentliggjort i Journal of the America n Chemical Society, syntetiserede kunstige celler for at påvise histamin. Da histamin blev påvist, udtrykte de kunstige celler et enzym, der for
Syntetiserer kemisk-sansende celler fra bundenEn undersøgelse offentliggjort i Journal of the America n Chemical Society, syntetiserede kunstige celler for at påvise histamin. Da histamin blev påvist, udtrykte de kunstige celler et enzym, der for -
 Forskere sætter nyt spin på gammel teknik for at konstruere bedre absorberende materialerUniversity of Illinois bioingeniører, fra venstre, Ayanjeet Ghosh, professor Rohit Bhargava, Prabuddha Mukherjee og Sanghamitra Deb bruger en opdateret infrarød billedbehandlingsteknik til bedre at un
Forskere sætter nyt spin på gammel teknik for at konstruere bedre absorberende materialerUniversity of Illinois bioingeniører, fra venstre, Ayanjeet Ghosh, professor Rohit Bhargava, Prabuddha Mukherjee og Sanghamitra Deb bruger en opdateret infrarød billedbehandlingsteknik til bedre at un -
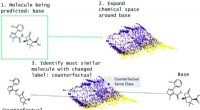 Brug af kontrafakta til at verificere forudsigelser om lægemiddelsikkerhedOversigt over MMACE. Inputtet er et molekyle, der skal forudsiges. Kemisk rum udvides og klynges. Kontrafakta er udvalgt fra klynger for at finde en kortfattet forklaring på forudsigelse af basemoleky
Brug af kontrafakta til at verificere forudsigelser om lægemiddelsikkerhedOversigt over MMACE. Inputtet er et molekyle, der skal forudsiges. Kemisk rum udvides og klynges. Kontrafakta er udvalgt fra klynger for at finde en kortfattet forklaring på forudsigelse af basemoleky
- Hvad er den mest sandsynlige formel for den ioniske forbindelse dannet mellem et alkalimetal X og ni…
- En forsikringsrabat for dine fitnessdata er en dårlig aftale i det lange løb
- Forskere kortlægger symbiotiske forhold mellem træer og mikrober verden over
- Tæt antarktisk vand vender tilbage til Atlanterhavet
- Ny NASA-undersøgelse kan forbedre fremtidige flodobservationssatellitter
- Graphene og terahertz -bølger kan lede vejen til fremtidig kommunikation


