Hvad er den empiriske formel for manganoxid?
Lad os antage, at vi har en prøve af manganoxid, og vi udfører elementær analyse på det. Resultaterne viser, at prøven indeholder 43,45% mangan og 56,55% oxygen efter masse.
For at beregne den empiriske formel skal vi konvertere disse masseprocenter til molfraktioner. Vi kan gøre dette ved at dividere massen af hvert grundstof med dets respektive atommasse og derefter dividere med summen af disse værdier:
Molfraktion af mangan (Mn) =(43,45 g / 54,94 g/mol) / (43,45 g / 54,94 g/mol + 56,55 g / 16,00 g/mol) =0,474
Molfraktion af oxygen (O) =(56,55 g / 16,00 g/mol) / (43,45 g / 54,94 g/mol + 56,55 g / 16,00 g/mol) =0,526
Dernæst skal vi forenkle molbrøkerne til det enkleste hele talforhold. For at gøre dette kan vi dividere begge molbrøker med den mindste molbrøk:
Forenklet molfraktion af mangan (Mn) =0,474 / 0,474 =1
Forenklet molfraktion af oxygen (O) =0,526 / 0,474 =1,11
Da de forenklede molfraktioner er tæt på hele tal på 1 og 1, er den empiriske formel for manganoxid cirka MnO.
Derfor er den empiriske formel for manganoxid MnO.
Sidste artikelNår calciumcarbonat nedbrydes oxid og kuldioxid dannes hvad er formlen?
Næste artikelKan jernoxid bruges som medicin?
 Varme artikler
Varme artikler
-
 At brygge en god kop kaffe afhænger af kemi og fysikHvad kan du gøre for at sikre en mere perfekt bryg? Kredit:Chris Hendon, CC BY-ND Kaffe er enestående blandt håndværksdrikke, idet bryggeren spiller en væsentlig rolle for dens kvalitet ved indtag
At brygge en god kop kaffe afhænger af kemi og fysikHvad kan du gøre for at sikre en mere perfekt bryg? Kredit:Chris Hendon, CC BY-ND Kaffe er enestående blandt håndværksdrikke, idet bryggeren spiller en væsentlig rolle for dens kvalitet ved indtag -
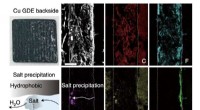 Brug af bifunktionelle ionomerer som elektrolytter til at syntetisere ethylen ud fra kuldioxidTværsnitsscanningselektronmikroskopi og energidispersiv røntgenspektroskopi elementær kortlægningsbilleder af Cu GDE efter elektrolyse, hvilket indikerer den alvorlige saltudfældning, der forekommer i
Brug af bifunktionelle ionomerer som elektrolytter til at syntetisere ethylen ud fra kuldioxidTværsnitsscanningselektronmikroskopi og energidispersiv røntgenspektroskopi elementær kortlægningsbilleder af Cu GDE efter elektrolyse, hvilket indikerer den alvorlige saltudfældning, der forekommer i -
 Et nyt værktøj til kryo-elektronmikroskopiMikroskopisk billede (øverst) og struktur (nederst) af proteinet hæmocyanin (højre) og tobaksmosaikvirus (til venstre) af iDPC-STEM. Nedenfor de tilsvarende 3D-strukturer ved 3,5 og 6,5 Å opløsning. K
Et nyt værktøj til kryo-elektronmikroskopiMikroskopisk billede (øverst) og struktur (nederst) af proteinet hæmocyanin (højre) og tobaksmosaikvirus (til venstre) af iDPC-STEM. Nedenfor de tilsvarende 3D-strukturer ved 3,5 og 6,5 Å opløsning. K -
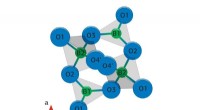 Kemikere opdager mekanismen for strålingsustabilitet af lithiumtetraboratKredit:RUDN Universitet Kemikere fra RUDN University har studeret mekanismen for strålingsustabilitet af termoluminoforer baseret på lithiumtetraborat, som bruges til fremstilling af strålingsdosi
Kemikere opdager mekanismen for strålingsustabilitet af lithiumtetraboratKredit:RUDN Universitet Kemikere fra RUDN University har studeret mekanismen for strålingsustabilitet af termoluminoforer baseret på lithiumtetraborat, som bruges til fremstilling af strålingsdosi
- Det er sandsynligt, at det vil slå til, men kan en ny smartphone redde Palm?
- CloudSat får et stykke Typhoon Yutus øje
- Hvad sker der, når toppredatoren fjernes fra et økosystem?
- Video:Kunstige blade til at producere brændstof på jorden og, en dag, Mars
- Smartwatches er der masser af:Men hvem vil egentlig have et?
- Er undervisning via Twitter en levedygtig mulighed?


