Hvad er forskellen mellem ioniske og kovalente bindinger?
Ionbindinger dannes, når der er en fuldstændig overførsel af elektroner fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Den elektrostatiske tiltrækning mellem disse modsat ladede ioner holder forbindelsen sammen.
Karakteristika for ioniske bindinger:
- Indebærer en overførsel af elektroner, hvilket fører til dannelse af ioner.
- Stærk elektrostatisk tiltrækning mellem ioner.
- Forbindelser er typisk krystallinske faste stoffer ved stuetemperatur.
- Høje smelte- og kogepunkter på grund af stærke ioniske interaktioner.
- Generelt opløselig i polære opløsningsmidler (f.eks. vand), men uopløselig i upolære opløsningsmidler.
- Leder elektricitet, når det er opløst eller smeltet, hvilket tillader bevægelser af ioner.
Kovalente bindinger:
Kovalente bindinger dannes, når to eller flere atomer deler elektroner for at opnå en stabil elektronkonfiguration. De delte elektroner er lokaliseret mellem atomkernerne og danner en stærk binding.
Karakteristika for kovalente bindinger:
- Indebærer deling af elektroner mellem atomer.
- Stærk tiltrækning mellem atomer på grund af delte elektronpar.
- Forbindelser kan eksistere som faste stoffer, væsker eller gasser ved stuetemperatur.
- Lavere smelte- og kogepunkter sammenlignet med ioniske forbindelser.
- Generelt uopløseligt i polære opløsningsmidler, men opløseligt i upolære opløsningsmidler.
- Dårlige ledere af elektricitet, undtagen i særlige tilfælde som metaller, hvor elektroner er delokaliseret.
Sammenfattende ligger den vigtigste forskel mellem ioniske og kovalente bindinger i arten af elektronoverførsel eller -deling. Ionbindinger involverer fuldstændig elektronoverførsel og elektrostatisk tiltrækning mellem ioner, mens kovalente bindinger involverer elektrondeling mellem atomer for at opnå stabilitet. Disse forskelle fører til forskellige egenskaber, såsom krystalstruktur, opløselighed og elektrisk ledningsevne.
Sidste artikelHvad er sammenhængen mellem pH-værdi og opløsningens art?
Næste artikelEr H2O varmt vand og CO2 koldt vand?
 Varme artikler
Varme artikler
-
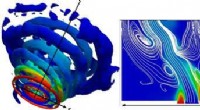 Minimering af ammoniak -brændstofemissionerTil venstre:Vortex strukturer af hvirvlende strømme. Til højre:Blanding af mønster af to ammoniakstrømme med luftstrømmen nær hvirvlerne, placeret i bunden af figuren. Farver angiver fordeling af am
Minimering af ammoniak -brændstofemissionerTil venstre:Vortex strukturer af hvirvlende strømme. Til højre:Blanding af mønster af to ammoniakstrømme med luftstrømmen nær hvirvlerne, placeret i bunden af figuren. Farver angiver fordeling af am -
 Sjældne jordarters elementer i mineindustriens affaldsbunkerWenzhong Zhang er miljøforkæmper fra Helsinki Universitet, der i sin doktorafhandling inden for kemien beskriver en metode til at opfange små mængder sjældne jordarters grundstoffer fra aluminiumsindu
Sjældne jordarters elementer i mineindustriens affaldsbunkerWenzhong Zhang er miljøforkæmper fra Helsinki Universitet, der i sin doktorafhandling inden for kemien beskriver en metode til at opfange små mængder sjældne jordarters grundstoffer fra aluminiumsindu -
 Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa
Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa -
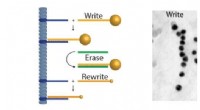 DNA som en supramolekylær byggestenKredit:Leiden Universitet Ph.d.-studerende Willem Noteborn har undersøgt supramolekylære strukturer. Disse kan være nyttige til indlæsning af medicin og signalmolekyler vedr. for eksempel, cellulæ
DNA som en supramolekylær byggestenKredit:Leiden Universitet Ph.d.-studerende Willem Noteborn har undersøgt supramolekylære strukturer. Disse kan være nyttige til indlæsning af medicin og signalmolekyler vedr. for eksempel, cellulæ
- Omkring 35, 000 år siden, Det centrale Iberia havde et tundra-steppelandskab
- Amazon leverer boost til den franske dagligvaregigant Monoprix
- Hvilke af dagens dyr levede sammen med dinosaurer?
- Fra tør til syndflod, hvor tung sne, regn oversvømmede Yellowstone
- Se Venus' roterende horn ved daggry
- Forskere præsenterer nye begrænsninger til direkte detektering af Sub-GeV mørkt stof


