Hvordan er mængden af hydroniumioner sammenlignet med hydroxidioner?
I rent vand ved 25 °C er koncentrationen af hydroniumioner lig med koncentrationen af hydroxidioner, og begge er meget lave (ca. 1 x 10^-7 mol pr. liter). Det betyder, at rent vand er neutralt med en pH-værdi på 7.
Når koncentrationen af hydroniumioner stiger, falder opløsningens pH, hvilket indikerer en sur opløsning. Omvendt, når hydroxidionkoncentrationen stiger, stiger pH, og opløsningen bliver basisk eller basisk.
Forholdet mellem hydroniumioner og hydroxidioner kan udtrykkes matematisk ved hjælp af følgende ligning:
[H3O+] × [OH-] =Kw
hvor Kw er ionproduktkonstanten for vand, som er en konstant værdi ved en given temperatur (ca. 1 x 10^-14 ved 25 °C).
Denne ligning viser, at hvis koncentrationen af hydroniumioner stiger, skal koncentrationen af hydroxidioner falde for at opretholde den konstante værdi af Kw. Tilsvarende, hvis hydroxidionkoncentrationen stiger, skal hydroniumionkoncentrationen falde.
Derfor er hydroniumionkoncentrationen højere i en sur opløsning, mens hydroxidionkoncentrationen er lavere. I en basisk opløsning er hydroxidionkoncentrationen højere, mens hydroniumionkoncentrationen er lavere. I en neutral opløsning er både hydronium- og hydroxidionkoncentrationerne meget lave og lige store.
 Varme artikler
Varme artikler
-
 Ny sensor registrerer værdifuldt sjældent jordelement terbium fra utraditionelle kilderProteinet lanmodulin er blevet udviklet til en sensor til at identificere det sjældne jordelement terbium fra komplekse miljøer, såsom syredrainafvanding. Sensoren, illustreret her, udsender grønt lys
Ny sensor registrerer værdifuldt sjældent jordelement terbium fra utraditionelle kilderProteinet lanmodulin er blevet udviklet til en sensor til at identificere det sjældne jordelement terbium fra komplekse miljøer, såsom syredrainafvanding. Sensoren, illustreret her, udsender grønt lys -
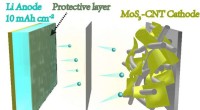 Kemikere finder en ny måde at skabe lithiummetalelektroder til batterierDette billede viser den skematiske struktur af en ny battericelle med lithiummetalelektroder udviklet ved Yale og Donghua University. Kredit:Yale University Forskere ved Yale og Donghua University
Kemikere finder en ny måde at skabe lithiummetalelektroder til batterierDette billede viser den skematiske struktur af en ny battericelle med lithiummetalelektroder udviklet ved Yale og Donghua University. Kredit:Yale University Forskere ved Yale og Donghua University -
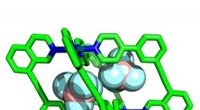 Hurtig måde at skabe molekylære bure på kunne forny søgningen efter nye materialerEt af holdets wonky bure, binding af to gæstemolekyler af aniontetrafluorboratet (BF - 4 ) inde i hulrummet. Kredit:Imperial College London En ny måde at forudsige resultatet af reaktioner kan
Hurtig måde at skabe molekylære bure på kunne forny søgningen efter nye materialerEt af holdets wonky bure, binding af to gæstemolekyler af aniontetrafluorboratet (BF - 4 ) inde i hulrummet. Kredit:Imperial College London En ny måde at forudsige resultatet af reaktioner kan -
 Forskerhold dechifrerer enzymatisk nedbrydning af sukker fra marine algerEnzymer er biokatalysatorer, der er afgørende for nedbrydningen af tangbiomasse i havene. For første gang, et internationalt hold af 19 forskere afkodede for nylig den komplette nedbrydningsvej for
Forskerhold dechifrerer enzymatisk nedbrydning af sukker fra marine algerEnzymer er biokatalysatorer, der er afgørende for nedbrydningen af tangbiomasse i havene. For første gang, et internationalt hold af 19 forskere afkodede for nylig den komplette nedbrydningsvej for
- Østrigske jernbaner siger, at antallet af nattogsreservationer stiger
- GULD instrument tager sit første billede af Jorden
- Hvad sker der med termisk energi i et bæger, når det køles ned?
- Support vokser til bæredygtig metode til fremstilling af kompositfiberplader
- Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængde
- Mange gasgigantiske exoplaneter venter på at blive opdaget


