Hvordan definerer bronsted lowry-teorien syrer og baser?
Syre :Et stof, der er i stand til at donere en proton (H+ ion).
Base :Et stof, der er i stand til at acceptere en proton (H+ ion).
I en kemisk reaktion overfører syren en proton til basen, hvilket resulterer i dannelsen af en konjugeret syre og en konjugeret base. Den konjugerede syre er den art, der bliver tilbage, efter at syren har doneret en proton, mens den konjugatbase er den art, der accepterer protonen.
For eksempel, når saltsyre (HCl) reagerer med vand, donerer HCl-molekylet en proton til vandmolekylet og danner den konjugerede syre H3O+ (hydroniumion) og den konjugerede base Cl- (chloridion).
HCl + H2O H3O+ + Cl-
Brønsted-Lowry teorien er mere generel end Arrhenius teorien, der definerer syrer som stoffer, der producerer H+ ioner, når de opløses i vand, og baser som stoffer, der producerer hydroxid (OH-) ioner, når de opløses i vand.
Brønsted-Lowry teorien kan anvendes på reaktioner i både vandige og ikke-vandige opløsningsmidler, og den kan også bruges til at beskrive syrer og basers adfærd i gasser.
Brønsted-Lowry teorien er et nyttigt værktøj til at forstå syre-base kemi. Det kan bruges til at forudsige produkterne af syre-base reaktioner, og det kan også bruges til at forklare syrer og basers adfærd i forskellige miljøer.
 Varme artikler
Varme artikler
-
 Petrovite:Forskere opdager et nyt mineral i KamchatkaPetrovit. Kredit:SPbU I mere end 40 år, forskere har studeret mineralogien af scoria-kegler og lavastrømme af fumaroler i Kamchatka. Funktionerne blev dannet efter to store udbrud af Tolbachik-v
Petrovite:Forskere opdager et nyt mineral i KamchatkaPetrovit. Kredit:SPbU I mere end 40 år, forskere har studeret mineralogien af scoria-kegler og lavastrømme af fumaroler i Kamchatka. Funktionerne blev dannet efter to store udbrud af Tolbachik-v -
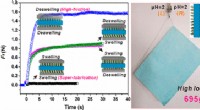 Syntetisk tosidet gekkoerfod kunne muliggøre undervandsrobotikKredit:American Chemical Society Gekkoer er velkendte for ubesværet at klatre op ad vægge og på hovedet over lofter. Selv i glatte regnskove, firbenene bevarer deres greb. Nu har forskere skabt et
Syntetisk tosidet gekkoerfod kunne muliggøre undervandsrobotikKredit:American Chemical Society Gekkoer er velkendte for ubesværet at klatre op ad vægge og på hovedet over lofter. Selv i glatte regnskove, firbenene bevarer deres greb. Nu har forskere skabt et -
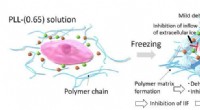 Ny indsigt sætter en stopper for mekanismerne til sikker kryokonservering af biologiske materialerNår celler fryses med PLL-(0,65), fryseprocessen koncentrerer PLL-(0,65)-molekylerne, hvilket igen får dem til at aggregeres på grund af stærke intermolekylære attraktionskræfter. Denne aggregering af
Ny indsigt sætter en stopper for mekanismerne til sikker kryokonservering af biologiske materialerNår celler fryses med PLL-(0,65), fryseprocessen koncentrerer PLL-(0,65)-molekylerne, hvilket igen får dem til at aggregeres på grund af stærke intermolekylære attraktionskræfter. Denne aggregering af -
 Et meget følsomt SERS-substrat til gassensingSERS-sensoren. Kredit:SIBET Sporgassensing er afgørende for overvågning af miljøforurening og detektering af flygtige organiske forbindelser frigivet fra den menneskelige krop. Som et kraftfuldt a
Et meget følsomt SERS-substrat til gassensingSERS-sensoren. Kredit:SIBET Sporgassensing er afgørende for overvågning af miljøforurening og detektering af flygtige organiske forbindelser frigivet fra den menneskelige krop. Som et kraftfuldt a
- Frigørelse af æblers genetiske plan:Form- og størrelsestræk afsløret
- Forskere i Hong Kong baner nye veje inden for nanoteknologi
- Matematisk ramme udforsker, hvordan hjernen holder et slag
- Forskere sætter fælder for atomer med enkeltpartikelpræcision
- En banebrydende NASA mini vejrsatellit afslutter sin mission
- Iboende optiske ikke-lineariteter og bæredynamik i InSe


