Hvordan finder man ud af, om en forbindelse er ionisk eller kovalent?
Elektronegativitetsforskel :
1. Ioniske forbindelser :Ionforbindelser dannes, når der er stor forskel i elektronegativitet mellem de involverede atomer. Elektronegativitet er et atoms evne til at tiltrække elektroner. Når elektronegativitetsforskellen mellem to atomer er større end 1,7, har de en tendens til at danne ionbindinger.
2. Kovalente forbindelser :Kovalente forbindelser dannes, når elektronegativitetsforskellen mellem atomer er relativt lille (mindre end 1,7). I kovalente bindinger deles elektroner mellem atomer i stedet for at blive overført fuldstændigt.
Klæbningens art :
1. Ioniske forbindelser :Ioniske forbindelser holdes sammen af elektrostatiske kræfter mellem positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Disse forbindelser danner typisk krystaller med et regelmæssigt arrangement af ioner.
2. Kovalente forbindelser :Kovalente forbindelser holdes sammen af kovalente bindinger, som involverer deling af elektroner mellem atomer. Kovalente bindinger kan være enkelt-, dobbelt- eller tredobbelt, afhængigt af antallet af delte elektronpar.
Opløselighed :
1. Ioniske forbindelser :Ioniske forbindelser er generelt opløselige i polære opløsningsmidler, såsom vand. Vandmolekyler kan adskille ionerne i forbindelsen på grund af deres polaritet.
2. Kovalente forbindelser :Kovalente forbindelser er ofte opløselige i ikke-polære opløsningsmidler, såsom organiske opløsningsmidler. Ikke-polære opløsningsmidler har ikke en signifikant effekt på de kovalente bindinger.
Smelte- og kogepunkter :
1. Ioniske forbindelser :Ioniske forbindelser har typisk høje smelte- og kogepunkter. Dette skyldes, at der skal meget energi til for at overvinde de stærke elektrostatiske kræfter mellem ionerne.
2. Kovalente forbindelser :Kovalente forbindelser har generelt lavere smelte- og kogepunkter end ioniske forbindelser. Dette skyldes, at kovalente bindinger er svagere end ionbindinger, og der kræves mindre energi for at bryde dem.
Ved at undersøge elektronegativitetsforskellen, arten af bindingen, opløseligheden og smelte- og kogepunkterne for en forbindelse, kan du bestemme, om den er ionisk eller kovalent.
Det er vigtigt at bemærke, at der kan være undtagelser fra disse generelle regler, og nogle forbindelser kan udvise karakteristika for både ioniske og kovalente bindinger.
Sidste artikelHvad er oxidationstallet for brint i forbindelsen HC1?
Næste artikelHvad sker der med kobbersulfat, når der tilsættes vand?
 Varme artikler
Varme artikler
-
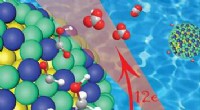 Ny kerne-skal katalysator til ethanol brændselscellerEt nærbillede af platin/iridium (grøn/blå) skallen over en guld nanopartikelkerne (gul), viser, hvordan denne katalysator spalter carbon-carbon (grå) bindingerne i ethanol, mens den oprindeligt efterl
Ny kerne-skal katalysator til ethanol brændselscellerEt nærbillede af platin/iridium (grøn/blå) skallen over en guld nanopartikelkerne (gul), viser, hvordan denne katalysator spalter carbon-carbon (grå) bindingerne i ethanol, mens den oprindeligt efterl -
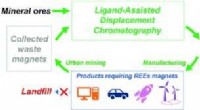 Teknologier til at udvinde, rense kritiske sjældne jordarters metaller kunne være en game changerKredit: Grøn Kemi (2020). DOI:10.1039/D0GC00495B Teknologien – udviklet og patenteret fra Nien-Hwa Linda Wangs laboratorium, Purdues Maxine Spencer Nichols professor i kemiteknik – har med succes
Teknologier til at udvinde, rense kritiske sjældne jordarters metaller kunne være en game changerKredit: Grøn Kemi (2020). DOI:10.1039/D0GC00495B Teknologien – udviklet og patenteret fra Nien-Hwa Linda Wangs laboratorium, Purdues Maxine Spencer Nichols professor i kemiteknik – har med succes -
 At lave mere MXene:Forskere løfter sløret for et skalerbart produktionssystem til de lovende, 2-D …Efter næsten et årti med forskning, der viser, at MXene-materialer kan bruges til at forbedre en række teknologier, Drexel-forskere har nu en måde at fremstille materialet i store nok partier til at b
At lave mere MXene:Forskere løfter sløret for et skalerbart produktionssystem til de lovende, 2-D …Efter næsten et årti med forskning, der viser, at MXene-materialer kan bruges til at forbedre en række teknologier, Drexel-forskere har nu en måde at fremstille materialet i store nok partier til at b -
 Forskning zoomer ind på enzym, der reparerer DNA-skader fra UV-strålerSLAC-associeret medarbejder videnskabsmand Thomas Joseph Lane ved instrumentet Coherent X-Ray Imaging (CXI) ved Linac Coherent Light Source (LCLS). Kredit:Miyuki Dougherty/SLAC National Accelerator La
Forskning zoomer ind på enzym, der reparerer DNA-skader fra UV-strålerSLAC-associeret medarbejder videnskabsmand Thomas Joseph Lane ved instrumentet Coherent X-Ray Imaging (CXI) ved Linac Coherent Light Source (LCLS). Kredit:Miyuki Dougherty/SLAC National Accelerator La
- Skrivefejl på Aussie $50 bringer rødme for centralbanken
- Krigens for mange ansigter - hvorfor i Afghanistan er så kompleks
- Hvordan man beregner molarabsorptionsevne
- De fleste forældre siger praktisk, intensivt forældreskab er bedst
- Biofysikere belyser mekanismer for neutrale opløste bærere
- Ingeniører skaber atomisk tynde supergittermaterialer med præcision


