Er konjugatet af en stærk base er svag syre?
Når en stærk base gennemgår protonering (vinder en hydrogenion, H+), danner den sin konjugerede syre. Da stærke baser fuldstændig dissocierer i vand og frigiver hydroxidioner (OH-) i opløsningen, har deres konjugerede syrer en begrænset evne til at donere protoner.
Som følge heraf er de konjugerede syrer af stærke baser svage syrer. De dissocierer delvist i vand og frigiver en begrænset mængde H+ ioner, hvilket resulterer i en relativt lav surhedsgrad. Omvendt er konjugatet af en stærk syre en svag base.
Sidste artikelEr NH4NO3 en stærk syre og svag base?
Næste artikelHvordan opbygges chlorfluorcarboner i atmosfæren?
 Varme artikler
Varme artikler
-
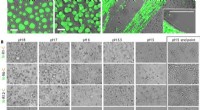 Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis
Væske-væske faseadskillelse fundet at drive processen med at konvertere spidroin-proteiner til edd…Forsuring udløser hurtig selvsamling af MaSp2 nanofibriller. (A) N-R12-C mærket med DyLight 488 (10 til 20 mg ml-1 slutkoncentration) blev blandet ind i 0,5 M KPi ved de angivne pH-værdier og visualis -
 Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø
Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø -
 Påvisning af kulilte i kroppen kan føre til hurtig sygdomsdiagnostikKredit:Imperial College London En hurtig og pålidelig måde at påvise niveauer af kulilte i kroppen kunne give klinikere mulighed for at diagnosticere sygdom. Kulilte betragtes normalt i forhold t
Påvisning af kulilte i kroppen kan føre til hurtig sygdomsdiagnostikKredit:Imperial College London En hurtig og pålidelig måde at påvise niveauer af kulilte i kroppen kunne give klinikere mulighed for at diagnosticere sygdom. Kulilte betragtes normalt i forhold t -
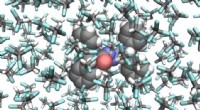 Forskere laver en fotografisk film af en molekylær switchMolekylær struktur af den fotoresponsive molekylære switch (i midten) omgivet af opløsningsmiddelmolekyler. Forskerne afslørede en lys-induceret pedalo-type bevægelse, som går både frem og tilbage. Bi
Forskere laver en fotografisk film af en molekylær switchMolekylær struktur af den fotoresponsive molekylære switch (i midten) omgivet af opløsningsmiddelmolekyler. Forskerne afslørede en lys-induceret pedalo-type bevægelse, som går både frem og tilbage. Bi
- I 50 år har massefængsling skadet amerikanske familier. Sådan ændres det
- Nyt papir undersøger uforholdsmæssig effekt af eugenik på North Carolinas sorte befolkning
- Modificeret arylomycin viste sig at være effektivt mod lægemiddelresistente bakterier
- Pansret med plastik "hår" og silica, nye perovskit nanokrystaller viser mere holdbarhed
- Forskere turbolader høj opløsning, 3D-billeddannelse
- Planet på størrelse med Neptun opdaget i kredsløb om unge, nærliggende stjerne


