Hvorfor har fluor en mindre atomradius end både oxygen og klor?
For fluor, ilt og klor hører alle tre grundstoffer til samme periode (periode 2). Fluor er yderst til venstre, efterfulgt af ilt og derefter klor. Derfor har fluor den mindste atomradius sammenlignet med ilt og klor på grund af at have det laveste atomnummer og den stærkeste nukleare ladning.
Her er en oversigt over de atomare radius af fluor, oxygen og klor:
- Fluor (F):72 picometers (pm)
- Ilt (O):73 kl
- Klor (Cl):99 kl
Som du kan se, har fluor den mindste atomradius blandt de tre elementer, i overensstemmelse med tendensen med faldende atomradius over en periode.
 Varme artikler
Varme artikler
-
 Planteinspirerede alkaloider beskytter ris, kiwi og citrus fra skadelige bakterierKredit:Pixabay/CC0 Public Domain Planter får bakterielle infektioner, ligesom mennesker gør. Når madafgrøder og træer er inficeret, deres udbytte og kvalitet kan lide. Selvom nogle forbindelser er
Planteinspirerede alkaloider beskytter ris, kiwi og citrus fra skadelige bakterierKredit:Pixabay/CC0 Public Domain Planter får bakterielle infektioner, ligesom mennesker gør. Når madafgrøder og træer er inficeret, deres udbytte og kvalitet kan lide. Selvom nogle forbindelser er -
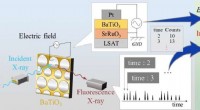 Fin struktur afsløret af potentielt alternativ til blyforbindelse, der bruges i sensorerFluorescensrøntgenstråler fra den tynde film BaTiO_3 detekteres af en solid state-detektor med tidsstempelinformation, som synkroniseres med den påførte spænding på filmen for at opnå tidsmæssig varia
Fin struktur afsløret af potentielt alternativ til blyforbindelse, der bruges i sensorerFluorescensrøntgenstråler fra den tynde film BaTiO_3 detekteres af en solid state-detektor med tidsstempelinformation, som synkroniseres med den påførte spænding på filmen for at opnå tidsmæssig varia -
 Plastfilm beskytter overflader mod ny coronavirus ved kontaktLaboratorietests viste, at film indeholdende sølv-silica nanopartikler var i stand til at fjerne 99,84% af SARS-CoV-2 partikler efter eksponering i to minutter. Kredit:Promaflex En klæbende plastf
Plastfilm beskytter overflader mod ny coronavirus ved kontaktLaboratorietests viste, at film indeholdende sølv-silica nanopartikler var i stand til at fjerne 99,84% af SARS-CoV-2 partikler efter eksponering i to minutter. Kredit:Promaflex En klæbende plastf -
 Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den
Stort skridt fremad i produktionen af grøn brintKredit:CC0 Public Domain Den første termodynamisk reversible kemiske reaktor, der er i stand til at producere brint som en ren produktstrøm, repræsenterer et transformationelt skridt fremad i den
- Kvasi-periodisk oscillation detekteret i Cygnus X-1
- Et NJIT vision therapy team vinder mest innovative i verdensomspændende VR konkurrence
- AI-drevet virtuel rotte giver indsigt i, hvordan hjerner styrer komplekse, koordinerede bevægelser
- Hvorfor coronavirus vil uddybe uligheden i vores forstæder
- Hvad er lydens hastighed i luft, når temperaturen er 20 CC?
- Driver til den største masseudryddelse i Jordens historie identificeret


