Hvordan mærker man en bohr-model til scandium?
| Energiniveau | Antal elektroner |
|---|---|
| K | 2 |
| L | 8 |
| M | 9 |
| N | 2 |
Kernen er placeret i centrum af atomet. Elektronskallene er mærket K, L, M og N, startende fra den inderste skal. Hver skal kan rumme et maksimalt antal elektroner, som angivet i tabellen. Elektronerne er arrangeret i underskaller inden for hver skal. S-underskallen kan maksimalt indeholde 2 elektroner, p-underskallen kan maksimalt rumme 6 elektroner, d-underskallen kan maksimalt rumme 10 elektroner, og f-underskallen kan maksimalt rumme 14 elektroner.
I skandium er elektronerne fordelt som følger:
* K shell:2 elektroner i 1s subshell
* L skal:8 elektroner i 2s og 2p subshells
* M shell:9 elektroner i 3s, 3p og 3d subshells
* N shell:2 elektroner i 4s subshell
Bohr-modellen af scandium viser arrangementet af elektroner i atomet. Elektronerne er arrangeret i skaller omkring kernen, hvor hver skal har et bestemt energiniveau. Elektronerne i den yderste skal er de mest løst bundet til kernen og er derfor de mest reaktive.
Sidste artikelHvad er en fast blanding i klasseværelset?
Næste artikelHvad sker der med klortabletter, hvis de bliver våde?
 Varme artikler
Varme artikler
-
 Statistiske design fremskynder optimeringen af lagdelte 2-D krystallerOptimering og vækst af tekstur Sb 2 Te 3 krystal ved statistisk design af eksperiment (DoE). Statistisk signifikante aflejringsfaktorer såsom temperatur, tryk, vækstrate, buffermaterialer, og buff
Statistiske design fremskynder optimeringen af lagdelte 2-D krystallerOptimering og vækst af tekstur Sb 2 Te 3 krystal ved statistisk design af eksperiment (DoE). Statistisk signifikante aflejringsfaktorer såsom temperatur, tryk, vækstrate, buffermaterialer, og buff -
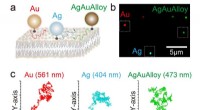 Hurtig og præcis flerfarvebilleddannelse af biomolekyler nu muligBrugen af guld, sølv og guld-sølv legering nanopartikler tillod højhastigheds/høj præcision flerfarve billeddannelse for første gang. Kredit:Ryota Iino, Institut for Molekylær Videnskab, National In
Hurtig og præcis flerfarvebilleddannelse af biomolekyler nu muligBrugen af guld, sølv og guld-sølv legering nanopartikler tillod højhastigheds/høj præcision flerfarve billeddannelse for første gang. Kredit:Ryota Iino, Institut for Molekylær Videnskab, National In -
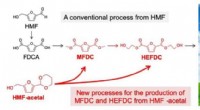 Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli
Grøn plastproduktion gjort letFigur 1. Reaktionsvej for produktion af MFDC og HEFDC fra HMF (en konventionel proces) og HMF-acetal (nye one-pot processer). Kredit:Kiyotaka Nakajima, Hokkaido Universitet En et-trins metode muli -
 Beton med forbedret slagfasthed til forsvarsstrukturerKredit:FEFU Ingeniører fra Center for Militære Studier ved Far Eastern Federal University (MSC FEFU) udviklede beton med forbedret slagfasthed og fremstillet af op til 40 procent affald fra risska
Beton med forbedret slagfasthed til forsvarsstrukturerKredit:FEFU Ingeniører fra Center for Militære Studier ved Far Eastern Federal University (MSC FEFU) udviklede beton med forbedret slagfasthed og fremstillet af op til 40 procent affald fra risska
- Heliumballoner tilbyder billige flyrejser til stratosfæren
- En videnskabsmand bruger kunstig selektion til at producere en ny type ko. Sammenlignet med deres fo…
- Når varme flytter fra komfuret til isterning kaldes?
- Er Donald Trump anti-videnskab? Dataene siger ja
- Behandlede fibre renser farvestofforurenet vand
- Hvor længe går der til effektive brændselsceller? Spørg eksperterne


