Hvorfor involverer kemiske reaktioner altid en ændring i energi?
Entalpiændringen af en kemisk reaktion er mængden af varme, der absorberes eller frigives af reaktionen ved konstant tryk. Hvis entalpiændringen af en reaktion er positiv, er reaktionen endoterm, og varme absorberes fra omgivelserne. Hvis entalpiændringen af en reaktion er negativ, er reaktionen eksoterm, og der frigives varme til omgivelserne.
Entropiændringen af en kemisk reaktion er ændringen i graden af uorden i systemet under reaktionen. Hvis entropiændringen af en reaktion er positiv, så er reaktionen spontan og vil ske uden behov for en ekstern energikilde. Hvis entropiændringen af en reaktion er negativ, så er reaktionen ikke-spontan og vil ikke forekomme uden behov for en ekstern energikilde.
Gibbs frie energiændring af en kemisk reaktion er den energi, der er tilgængelig til at udføre arbejde under reaktionen. Hvis Gibbs fri energiændring af en reaktion er negativ, så er reaktionen spontan og vil ske uden behov for en ekstern energikilde. Hvis Gibbs fri energiændring af en reaktion er positiv, så er reaktionen ikke-spontan og vil ikke forekomme uden behov for en ekstern energikilde.
Sammenfattende involverer kemiske reaktioner altid en ændring i energi, fordi de involverer brydning og dannelse af kemiske bindinger. Mængden af energi, der absorberes eller frigives under en kemisk reaktion, afhænger af styrken af de kemiske bindinger, der brydes og dannes. Entalpiændringen, entropiændringen og Gibbs frie energiændring af en kemisk reaktion er alle vigtige faktorer, der bestemmer, om reaktionen vil være spontan eller ikke-spontan.
 Varme artikler
Varme artikler
-
 Hvordan bakterier bygger hypereffektive fotosyntesemaskinerNyt strukturelt bevis viser, at det cyanobakterielle protein CcmM (orange) binder sig til færdigsamlede RuBisCo -enzymer (gul og grøn) uden at løsne RbcS -underenheder (gul). Denne tværbundne blanding
Hvordan bakterier bygger hypereffektive fotosyntesemaskinerNyt strukturelt bevis viser, at det cyanobakterielle protein CcmM (orange) binder sig til færdigsamlede RuBisCo -enzymer (gul og grøn) uden at løsne RbcS -underenheder (gul). Denne tværbundne blanding -
 Ny teori lover at omforme, hvordan vi tænker om polymeroverbygningerI en dobbelt-gyroide trænger to materialer (her afbildet som røde og blå) grundigt ind i hinanden. Kredit:Reddy et al., Nature Communications (2022) Polymerforskere ved University of Massachusetts
Ny teori lover at omforme, hvordan vi tænker om polymeroverbygningerI en dobbelt-gyroide trænger to materialer (her afbildet som røde og blå) grundigt ind i hinanden. Kredit:Reddy et al., Nature Communications (2022) Polymerforskere ved University of Massachusetts -
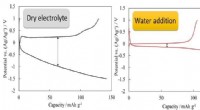 Elektrolyttens struktur styrer batteriets ydeevneVi har fundet ud af, at tilsætning af vand i høj grad reducerer forskellen i spænding (overspænding) mellem opladning/afladning. Kredit:COPYRIGHT (C) TOYOHASHI UNIVERSITY OF TECHNOLOGY. Forskerhol
Elektrolyttens struktur styrer batteriets ydeevneVi har fundet ud af, at tilsætning af vand i høj grad reducerer forskellen i spænding (overspænding) mellem opladning/afladning. Kredit:COPYRIGHT (C) TOYOHASHI UNIVERSITY OF TECHNOLOGY. Forskerhol -
 Ny kemisk modifikation af en naturlig forbindelse til kræftbehandlingGonçalo Bernardes, Principal Investigator ved iMM og medleder af undersøgelsen. Kredit:Gonçalo Ribeiro, iMM Naturlige forbindelser har ofte et lovende terapeutisk potentiale, men at bruge dem til a
Ny kemisk modifikation af en naturlig forbindelse til kræftbehandlingGonçalo Bernardes, Principal Investigator ved iMM og medleder af undersøgelsen. Kredit:Gonçalo Ribeiro, iMM Naturlige forbindelser har ofte et lovende terapeutisk potentiale, men at bruge dem til a
- Forskere afdækker usædvanlig glasagtig adfærd i et uordnet protein
- Mumificerede papegøjer peger på handel i den gamle Atacama-ørken
- Hvad er stærkere NaOH eller NH3?
- Rosens livscyklus
- Selv de ældste eukaryote fossiler viser blændende mangfoldighed og kompleksitet
- Normal vejrtrækning sender spytdråber 7 fod; masker forkorter dette


