Hvad leder metaller i naturen?
1. Valenselektroner: Metaller har løst bundne valenselektroner i deres yderste energiniveau. Disse valenselektroner er ikke stærkt tiltrukket af den positivt ladede atomkerne. Denne svage tiltrækning tillader valenselektroner at bevæge sig frit inden for metallets gitterstruktur.
2. Metallisk limning: Metaller har en unik type kemisk binding kaldet metallisk binding. Ved metallisk binding er de positivt ladede metalioner arrangeret i et regelmæssigt mønster, der danner en gitterstruktur. De løst bundne valenselektroner er ikke forbundet med nogen bestemt metalion, men bevæger sig i stedet frit gennem gitteret. Dette "hav" af mobile valenselektroner er det, der tillader metaller at lede elektricitet og varme effektivt.
3. Delokaliserede elektroner: De mobile valenselektroner i metaller er ikke lokaliseret til specifikke atomer, men er i stedet delokaliseret gennem hele gitterstrukturen. Denne delokalisering resulterer i en kontinuerlig bane for strømmen af elektroner, der tillader elektrisk strøm og varme at passere gennem metallet med minimal modstand.
4. Kollisioner: I metaller kan de frit bevægelige valenselektroner let kollidere med naboatomer, mens de bevæger sig gennem gitteret. Disse kollisioner overfører energi effektivt, hvilket bidrager til metallernes høje varmeledningsevne.
Som et resultat af disse egenskaber bruges metaller som kobber, aluminium, sølv og guld almindeligvis i forskellige elektriske og termiske applikationer på grund af deres exceptionelle evne til at lede elektricitet og varme effektivt.
 Varme artikler
Varme artikler
-
 Bygninger dyrket af bakterier:Ny forskning for at omdanne celler til minifabrikker til materialerEn blok af sandpartikler holdt sammen af levende celler. Kredit:University of Colorado Boulder College of Engineering and Applied Science, CC BY-ND Bygninger er ikke ulig en menneskekrop. De har
Bygninger dyrket af bakterier:Ny forskning for at omdanne celler til minifabrikker til materialerEn blok af sandpartikler holdt sammen af levende celler. Kredit:University of Colorado Boulder College of Engineering and Applied Science, CC BY-ND Bygninger er ikke ulig en menneskekrop. De har -
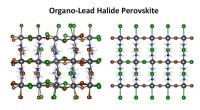 Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes
Forskere udvikler innovative teknikker til højopløsningsanalyse af hybridmaterialerSkematisk af organo-blyhalogenidperovskit, der viser forvrængninger fra tilfældige halogenidpositioner (venstre) versus ordnede halogenidpositioner (højre). Et Berkeley Lab-studie viser, at der findes -
 Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø
Afkodning af de grundlæggende mekanismer for menneskelig spytsmøringKredit:CC0 Public Domain Et tværfagligt team af forskere ledet af University of Leeds har afsløret den grundlæggende mekanisme, hvorved menneskets spyt smører vores mund. Deres multi-skala undersø -
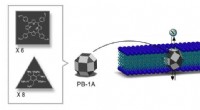 Syntetiske nanokanaler til jodidtransport3-D struktur af den syntetiske iodid-transporter PB-1A udviklet af IBS forskere. PB-1A-design følger formen af 26-sidet polyeder lavet af trekanter og firkanter (mørkegrå) med 12 flader efterladt to
Syntetiske nanokanaler til jodidtransport3-D struktur af den syntetiske iodid-transporter PB-1A udviklet af IBS forskere. PB-1A-design følger formen af 26-sidet polyeder lavet af trekanter og firkanter (mørkegrå) med 12 flader efterladt to
- Åndbare lavadragter:vulkanolog felttestet og godkendt
- Design af selvsamlende protein nanomaskiner begynder at klikke
- Måling af en dynamisk topologisk ordensparameter i kvanteture
- Mindst 40 dræbt i alvorlige oversvømmelser i det nordlige Tyrkiet
- Hvordan et ballonbåret eksperiment kan gøre arbejdet med Hubble-rumteleskopet
- Ny AI opfylder profit- og risikomål for komplekse finansielle porteføljer


