Hvor mange liter vand kan der laves af 34 gram ilt og 6,0 brint ved STP?
$$2H_2 + O_2 → 2H_2O$$
Ud fra ligningen kan vi se, at 2 mol brint reagerer med 1 mol ilt og producerer 2 mol vand.
Først skal vi omdanne de givne masser af oxygen og brint til mol:
$$n_{O_2} =\frac{34 \text{ g}}{32 \text{ g/mol}} =1,0625 \text{ mol}$$
$$n_{H_2} =\frac{6,0 \text{ g}}{2 \text{ g/mol}} =3,0 \text{ mol}$$
Ved at sammenligne molforholdet mellem oxygen og brint med det støkiometriske forhold kan vi se, at brint er i overskud. Derfor vil vi bruge oxygen som den begrænsende reaktant til at beregne mængden af produceret vand.
$$n_{H_2O} =2n_{O_2} =2 \ gange 1,0625 \text{ mol} =2,125 \text{ mol}$$
Nu kan vi konvertere mol vand til liter ved hjælp af den ideelle gaslov ved STP (standard temperatur og tryk):
$$PV =nRT$$
Ved STP er temperaturen 273 K og trykket er 1 atm. Den ideelle gaskonstant er R =0,08206 L atm/mol K.
$$V_{H_2O} =\frac{n_{H_2O}RT}{P} =\frac{2.125 \text{ mol} \times 0,08206 \text{ L atm/mol K} \times 273 \text{ K}} {1 \text{ atm}}$$
$$V_{H_2O} =48,6 \text{ L}$$
Derfor kan 34 gram ilt og 6,0 gram brint ved STP producere 48,6 liter vand.
Sidste artikelHvad leder metaller i naturen?
Næste artikelHvorfor er røret med varme gasser lavet af kobberspiral?
 Varme artikler
Varme artikler
-
 Hvidløg og fluor kombination viser lovende som lægemiddelbehandlingKunne kombinationen af hvidløg og fluor være fremtiden for lægemiddelterapi? Kredit:University at Albany Der er meget mere ved hvidløg end dens karakteristiske lugt og stærke, skarp smag. I årh
Hvidløg og fluor kombination viser lovende som lægemiddelbehandlingKunne kombinationen af hvidløg og fluor være fremtiden for lægemiddelterapi? Kredit:University at Albany Der er meget mere ved hvidløg end dens karakteristiske lugt og stærke, skarp smag. I årh -
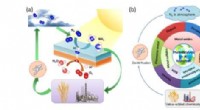 Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W
Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W -
 Video:Hvad er hvid chokolade?Kredit:The American Chemical Society I dag, vi viser vores kærlighed til hvid chokolade. Jo da, den mangler den rige smag af mælkechokolade og den blanke brune farve af mørk chokolade. Og mange m
Video:Hvad er hvid chokolade?Kredit:The American Chemical Society I dag, vi viser vores kærlighed til hvid chokolade. Jo da, den mangler den rige smag af mælkechokolade og den blanke brune farve af mørk chokolade. Og mange m -
 Udførelse af kemi i flydende dråberKredit:California Institute of Technology Kunne kemikere være klar til at droppe det ærværdige reagensglas, selve symbolet på kemi i mange menneskers sind? Måske ikke helt endnu men Caltechs Jack
Udførelse af kemi i flydende dråberKredit:California Institute of Technology Kunne kemikere være klar til at droppe det ærværdige reagensglas, selve symbolet på kemi i mange menneskers sind? Måske ikke helt endnu men Caltechs Jack
- Undersøgelse viser, at betalt familieorlov ikke skader arbejdsgivere
- Hvad går der over i genetik?
- Er det muligt at teste et atomvåben uden at producere radioa
- Virgin Atlantic -konsortiet går med til at købe Flybe
- Fra Paris til Shanghai, mennesker er stort set uvidende om risici for indendørs luftforurening
- Gammel europæisk satellit styrter harmløst gennem atmosfæren over Stillehavet


