Hvad er låneparelektron?
Eksempler på molekyler eller ioner med ensomme elektronpar omfatter:
- Vand (H2O):hvert iltatom har to ensomme elektronpar
- Ammoniak (NH3):nitrogenatomet har et enkelt par elektroner
- Kuldioxid (CO2):hvert iltatom har to enlige elektronpar
Ensomme elektronpar kan spille en vigtig rolle i molekylers egenskaber og reaktivitet. For eksempel kan de være involveret i hydrogenbinding, som er en type ikke-kovalent interaktion mellem et hydrogenatom og et elektronegativt atom (såsom nitrogen, oxygen eller fluor). Ensomme elektronpar kan også gøre molekyler mere reaktive ved at give et sted for nukleofilt angreb.
Sidste artikelHvad er den specifikke anvendelse af første lav termodynamik?
Næste artikelHvordan tilføjer man elektroner?
 Varme artikler
Varme artikler
-
 Et forskerhold udvikler biotransistorer, der er i stand til at detektere de mindste signalerKredit:CC0 Public Domain En af de tests, som næsten hver patient skal stå over for før en operation eller anden sundhedsintervention, er et elektrokardiogram. For at udføre denne screening, læger
Et forskerhold udvikler biotransistorer, der er i stand til at detektere de mindste signalerKredit:CC0 Public Domain En af de tests, som næsten hver patient skal stå over for før en operation eller anden sundhedsintervention, er et elektrokardiogram. For at udføre denne screening, læger -
 Ny tilgang skaber en enestående enkeltatomskatalysator til vandopdelingEn illustration viser et nyt system udviklet på SLAC og Stanford, der forankrer individuelle iridiumatomer til overfladen af en katalysator, øger dens effektivitet ved spaltning af vand til rekordni
Ny tilgang skaber en enestående enkeltatomskatalysator til vandopdelingEn illustration viser et nyt system udviklet på SLAC og Stanford, der forankrer individuelle iridiumatomer til overfladen af en katalysator, øger dens effektivitet ved spaltning af vand til rekordni -
 Molekyler fra modermælk og tang foreslår strategier til bekæmpelse af norovirusNorovirus. Kredit:CDC Norovirus er den mest almindelige årsag til gastroenteritis på verdensplan; det forårsager titusindvis af dødsfald hvert år og er særligt risikabelt for børn under 3 år. Hvis
Molekyler fra modermælk og tang foreslår strategier til bekæmpelse af norovirusNorovirus. Kredit:CDC Norovirus er den mest almindelige årsag til gastroenteritis på verdensplan; det forårsager titusindvis af dødsfald hvert år og er særligt risikabelt for børn under 3 år. Hvis -
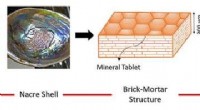 Udvikling af multifunktionelle kompositmaterialer til rumfartsapplikationerIndersiden af en østersskal er foret med perlemor eller perlemor, som kan give inspiration til design af MXene-baserede kompositter. Kredit:South Dakota State University Materialer til rumfartsa
Udvikling af multifunktionelle kompositmaterialer til rumfartsapplikationerIndersiden af en østersskal er foret med perlemor eller perlemor, som kan give inspiration til design af MXene-baserede kompositter. Kredit:South Dakota State University Materialer til rumfartsa
- Forskere udnytter metanforbrugende mikrober til brug i industrielle applikationer
- Har kviksølv satellitter og robotter, hvad hedder de?
- Hvad er vind resultatet af?
- Hektisk kamp for at beskytte kysten, da forværring af Orange County oliespild stilker strande
- Babyhvidhajer foretrækker at være tættere på kysten, finder videnskabsmænd
- Hvordan Pilbara blev dannet for mere end 3 milliarder år siden


