Hvorfor udvider gasser sig mere end faste eller væsker, når de opvarmes?
1. Kinetisk energi:
- Når gasser opvarmes, stiger den gennemsnitlige kinetiske energi af deres molekyler. Dette får molekylerne til at bevæge sig hurtigere og kollidere med hinanden og beholdervæggene hyppigere og med større kraft.
- De øgede kollisioner skubber gaspartiklerne længere fra hinanden, hvilket resulterer i en udvidelse af gasvolumenet.
2. Interparticle Spacing:
- Gasmolekyler har større mellemrum mellem partiklerne sammenlignet med faste stoffer og væsker. Det betyder, at den gennemsnitlige afstand mellem gasmolekyler er større.
- Når gasser opvarmes, overvinder den øgede kinetiske energi de intermolekylære kræfter, der holder gasmolekylerne sammen. Dette gør det muligt for molekylerne at sprede sig yderligere, hvilket får gassen til at udvide sig.
3. Kompressibilitet:
- Gasser er meget komprimerbare sammenlignet med faste stoffer og væsker. Det betyder, at gasser lettere kan komprimeres til at optage et mindre volumen.
- Når gasser opvarmes, øges deres kompressibilitet. Dette gør det lettere for gasmolekylerne at bevæge sig tættere sammen, hvilket yderligere bidrager til udvidelsen af gasvolumenet.
4. Fravær af langrækkende intermolekylære kræfter:
- I modsætning til faste stoffer og væsker mangler gasser stærke langrækkende intermolekylære kræfter såsom kovalente bindinger eller hydrogenbindinger.
- Dette fravær af stærke intermolekylære kræfter gør det muligt for gasmolekyler at bevæge sig mere frit og uafhængigt, når de opvarmes. Den øgede molekylære bevægelse fører til udvidelse af gassen.
I modsætning hertil har faste stoffer og væsker stærkere intermolekylære kræfter og mere tætpakkede partikler. Stigningen i kinetisk energi på grund af opvarmning er ikke tilstrækkelig til at overvinde disse kræfter og væsentligt øge interpartikelafstanden. Derfor udvider faste stoffer og væsker sig i mindre grad sammenlignet med gasser, når de opvarmes.
Sidste artikelHvad sker der med faste stoffer og væsker ved opvarmning?
Næste artikelHvad er en gass indre friktion?
 Varme artikler
Varme artikler
-
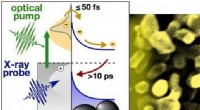 Forskere fanger ærlige øjebliksbilleder af elektroner, der høster lys i atomskalaenIllustration af et PEC-modelsystem med 20-nanometer guld nanopartikler fastgjort til titandioxid. Kredit:Berkeley Lab I søgen efter rene energialternativer til fossile brændstoffer, en lovende løs
Forskere fanger ærlige øjebliksbilleder af elektroner, der høster lys i atomskalaenIllustration af et PEC-modelsystem med 20-nanometer guld nanopartikler fastgjort til titandioxid. Kredit:Berkeley Lab I søgen efter rene energialternativer til fossile brændstoffer, en lovende løs -
 Ny elektrokatalysator udkonkurrerer platin i produktionen af alkalisk brintDen nye katalysator er et nanostruktureret kompositmateriale sammensat af carbon nanotråde med rutheniumatomer bundet til nitrogen og carbon for at danne aktive steder i carbonmatrixen. Elektronmikros
Ny elektrokatalysator udkonkurrerer platin i produktionen af alkalisk brintDen nye katalysator er et nanostruktureret kompositmateriale sammensat af carbon nanotråde med rutheniumatomer bundet til nitrogen og carbon for at danne aktive steder i carbonmatrixen. Elektronmikros -
 Forskere afslører hemmeligheden bag materiale til lovende infrarøde kameraerBolometer. Kredit:Daria Sokol/MIPT Forskere fra Moskva Institut for Fysik og Teknologi og RAS Institute for Theoretical and Applied Electromagnetics har opdaget, hvad der får vanadiumdioxidfilm ti
Forskere afslører hemmeligheden bag materiale til lovende infrarøde kameraerBolometer. Kredit:Daria Sokol/MIPT Forskere fra Moskva Institut for Fysik og Teknologi og RAS Institute for Theoretical and Applied Electromagnetics har opdaget, hvad der får vanadiumdioxidfilm ti -
 Forskere udvikler en måde at bedre forudsige korrosion fra råolieKredit:iStockphoto.com Ved hjælp af røntgenteknikker, forskere udvikler et analyseværktøj, der mere præcist kan forudsige, hvordan svovlforbindelser i et parti råolie kan tære udstyr - et vigtigt
Forskere udvikler en måde at bedre forudsige korrosion fra råolieKredit:iStockphoto.com Ved hjælp af røntgenteknikker, forskere udvikler et analyseværktøj, der mere præcist kan forudsige, hvordan svovlforbindelser i et parti råolie kan tære udstyr - et vigtigt
- Effekten af temperatur på cellemembraner
- Hvordan folk i immigrationsfængsling forsøger at klare livet i limbo
- Lys på himlen fra Elon Musks nye satellitnetværk har stjernekiggere bekymrede
- Global trio af orbitere viser, at små støvstorme hjælper med at udtørre Mars
- Sådan tilføjes fragmenter, der har forskellige betegnelser
- Hvilke forbindelser indeholder svovl?


