Ved konstant tryk optager en fast masse gas volumen 20m3 ved 27 0 c temperatursystemet blev øget til 177 beregn er ny optaget af gas?
V1/T1 =V2/T2
hvor V1 og T1 repræsenterer henholdsvis startvolumen og temperatur, og V2 og T2 repræsenterer henholdsvis slutvolumen og temperatur.
I dette tilfælde ved vi, at startvolumenet (V₁) er 20 m³, starttemperaturen (T₁) er 27 °C, og sluttemperaturen (T₂) er 177 °C. Vi skal finde det endelige volumen (V₂).
Først skal vi omregne temperaturerne til Kelvin. Vi tilføjer 273 til hver temperatur:
T1 =27 °C + 273 =300 K
T2 =177 °C + 273 =450 K
Nu kan vi erstatte værdierne i Charles's lovligning:
V1/T1 =V2/T2
20 m³ / 300 K =V₂ / 450 K
Ved at løse for V₂ får vi:
V₂ =(20 m³ * 450 K) / 300 K
V2 =30 m3
Derfor er det nye volumen optaget af gassen 30 m³.
Sidste artikelHvad er termisk konvertering?
Næste artikelHvordan bevæger varme sig fra fast stof til væske?
 Varme artikler
Varme artikler
-
 Gennemsigtigt træ:fremtidens byggemateriale?Gennemsigtigt træ skabes ved at fjerne lignin fra træ og erstatte det med en polymer. Kredit:WILEY‐VCH Verlag GmbH &Co. KGaA, Weinheim, licenseret under CC BY-NC-ND 4.0 Da Timothée Boitouzet stude
Gennemsigtigt træ:fremtidens byggemateriale?Gennemsigtigt træ skabes ved at fjerne lignin fra træ og erstatte det med en polymer. Kredit:WILEY‐VCH Verlag GmbH &Co. KGaA, Weinheim, licenseret under CC BY-NC-ND 4.0 Da Timothée Boitouzet stude -
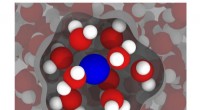 Moderne simuleringer kan forbedre MRI'erEn illustration baseret på simuleringer fra Rice Universitys ingeniører viser en gadoliniumion (blå) i vand (rød og hvid), med vand i den indre sfære - det vand, der er mest påvirket af gadolinium - f
Moderne simuleringer kan forbedre MRI'erEn illustration baseret på simuleringer fra Rice Universitys ingeniører viser en gadoliniumion (blå) i vand (rød og hvid), med vand i den indre sfære - det vand, der er mest påvirket af gadolinium - f -
 Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d
Fotoinitiatorer til tandfyldninger, kontaktlinser og tandproteserForskere ved Graz University of Technology har udviklet en ny, væsentligt billigere produktionsmetode for germanium-baserede fotoinitiatorer. Dette åbner op for yderligere anvendelsesområder ud over d -
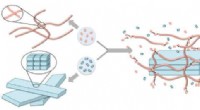 Molekylært stillads hjælper konstruktion på nanoskalaKredit:Okinawa Institute of Science and Technology Graduate University Hvis du vil bygge et højt hus, du skal bruge stillads. Professor Ye Zhang og kolleger ved Okinawa Institute of Science and Te
Molekylært stillads hjælper konstruktion på nanoskalaKredit:Okinawa Institute of Science and Technology Graduate University Hvis du vil bygge et højt hus, du skal bruge stillads. Professor Ye Zhang og kolleger ved Okinawa Institute of Science and Te
- Kroppen har et meget effektivt indre forsvar, som kan fjerne enhver mængde af et uønsket stof?
- Har en stor meteorit ramt jorden 12, 800 år siden? Her er nye beviser
- Californiens løbeild blusser, men inden for linje besætninger har bygget
- Hvad er de to kropssystemer involveret i regulering?
- Sådan konverteres måling af kubiske fødder til Tons
- Overraskende indsigt om affaldsstrømme på Mars


