Forbindelsen CO2 sublimerer let ved 25 grader Celsius Hvilke egenskaber er normalt forbundet med en, der gennemgår denne form for forandring?
Højt damptryk :Sublimering opstår, når et fast stof direkte omdannes til en gas uden at passere gennem væskefasen. Denne proces drives af, at det faste stofs molekyler får nok energi til at overvinde de intermolekylære kræfter, der holder dem sammen og undslipper til gasform. En forbindelse med et højt damptryk ved en given temperatur har en større tendens til at sublimere, fordi dens molekyler har en højere kinetisk energi og er mere tilbøjelige til at overvinde de intermolekylære kræfter.
Svage intermolekylære kræfter :De intermolekylære kræfter mellem molekyler spiller en afgørende rolle for at bestemme et stofs fysiske egenskaber. Forbindelser med svage intermolekylære kræfter, såsom van der Waals-kræfter, har tendens til at have lavere smelte- og kogepunkter og er mere tilbøjelige til at sublimere let. Stærkere intermolekylære kræfter, såsom hydrogenbinding eller ionbindinger, kræver mere energi at overvinde, hvilket gør sublimering mindre sandsynlig.
Molekylær struktur :En forbindelses molekylære struktur kan påvirke dens sublimeringsegenskaber. Forbindelser med en simpel molekylær struktur, såsom kuldioxid (CO2) eller jod (I2), har en tendens til at sublimere lettere sammenlignet med forbindelser med komplekse strukturer eller højere molekylvægte.
Lavt smeltepunkt :Forbindelser, der let sublimerer, har typisk lave smeltepunkter. Dette skyldes, at den energi, der kræves til sublimering, er tæt forbundet med den energi, der kræves til smeltning. Forbindelser med lave smeltepunkter har svagere intermolekylære kræfter og har en tendens til at sublimere lettere.
Det er vigtigt at bemærke, at en forbindelses sublimeringsadfærd også kan påvirkes af eksterne faktorer som temperatur og tryk. Ved at kontrollere disse forhold er det muligt at inducere eller undertrykke sublimering til forskellige praktiske anvendelser.
 Varme artikler
Varme artikler
-
 Eck Industries licenserer udelukkende cerium-aluminiumslegering udviklet af ORNLEt cylinderhoved støbt af Eck Industries ved hjælp af Ce-Al-legeringen og testet hos ORNL. Kredit:Oak Ridge National Laboratory Wisconsins Eck Industries har underskrevet en eksklusiv licens til k
Eck Industries licenserer udelukkende cerium-aluminiumslegering udviklet af ORNLEt cylinderhoved støbt af Eck Industries ved hjælp af Ce-Al-legeringen og testet hos ORNL. Kredit:Oak Ridge National Laboratory Wisconsins Eck Industries har underskrevet en eksklusiv licens til k -
 Genskabelse af interstellare ioner med lasereMSUs Marcos Dantus har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er blevet kaldt det molekyle, der skabte universet, hvor det spiller en større rolle i ast
Genskabelse af interstellare ioner med lasereMSUs Marcos Dantus har genskabt interstellare ioner med lasere. Kredit:MSU Trihydrogen, eller H 3 + , er blevet kaldt det molekyle, der skabte universet, hvor det spiller en større rolle i ast -
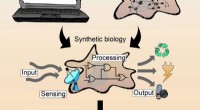 Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at
Biologiske signalprocesser i intelligente materialerKredit:Albert-Ludwigs-Universität Freiburg Forskere fra University of Freiburg har udviklet materialesystemer, der er sammensat af biologiske komponenter og polymermaterialer og er i stand til at -
 Video:Whiskys kemiKredit:The American Chemical Society Derby Day er rundt om hjørnet, og med det kommer store hatte, heste med sjove navne, og bourbon. Den seneste episode af Reactions fejrer den kemiske destillati
Video:Whiskys kemiKredit:The American Chemical Society Derby Day er rundt om hjørnet, og med det kommer store hatte, heste med sjove navne, og bourbon. Den seneste episode af Reactions fejrer den kemiske destillati
- Hvad bruges uran til?
- Manfred Eigen, 1967 nobelpristager i kemi, dør som 91-årig
- Forskere opfordrer til at bruge forbrugsbaseret regnskab over kulstofemissioner for at øge retfærd…
- Stjerner vs. støv i Carina-tågen
- Forskere reducerer usikkerheden i skovens kulstoflagringsberegninger
- Forskere afbilder en lys meteoroideksplosion i Jupiters atmosfære


