Hvad er et uorganisk fast stof?
De er karakteriseret ved deres stive krystalstruktur, hvor atomer, ioner eller molekyler er arrangeret i et gentaget mønster. Disse faste stoffer har veldefinerede smeltepunkter og kogepunkter, og deres fysiske egenskaber, såsom hårdhed og tæthed, er påvirket af deres atomarrangementer og bindingstyper.
Her er et par eksempler på uorganiske faste stoffer:
1. Metaller :Metaller er grundstoffer, der let taber elektroner for at danne positive ioner (kationer). De er typisk skinnende, formbare, duktile og gode ledere af varme og elektricitet. Eksempler på metalfaststoffer omfatter jern, aluminium, kobber og guld.
2. Ioniske forbindelser :Ioniske forbindelser er sammensat af positivt ladede ioner (kationer) og negativt ladede ioner (anioner) holdt sammen af elektrostatiske kræfter. De er normalt krystallinske, hårde, sprøde og har høje smeltepunkter. Eksempler omfatter natriumchlorid (NaCl), kaliumnitrat (KNO3) og magnesiumoxid (MgO).
3. Kovalente forbindelser :Kovalente forbindelser dannes ved deling af elektroner mellem atomer. De kan eksistere som molekylære faste stoffer, såsom kuldioxid (CO2), eller som netværkskovalente faste stoffer, såsom diamant og siliciumdioxid (SiO2). I molekylære faststoffer holdes molekylerne sammen af svage intermolekylære kræfter, mens atomerne i netværkskovalente faste stoffer er stærkt bundet til hinanden gennem kovalente bindinger.
4. Salte :Salte er ioniske forbindelser, der dannes ved reaktion mellem en syre og en base. De opløses typisk i vand for at danne ioner og er vigtige elektrolytter. Eksempler omfatter natriumchlorid (NaCl), kaliumsulfat (K2SO4) og calciumcarbonat (CaCO3).
Uorganiske faste stoffer omfatter en lang række stoffer og spiller væsentlige roller inden for forskellige områder, såsom byggematerialer, elektronik, katalyse, energilagring og mange industrielle processer.
Sidste artikelHvordan påvirker vanddamp miljøet?
Næste artikelHvad er reaktion af 1-chlorbutan med natriumethoxid?
 Varme artikler
Varme artikler
-
 Nye superkondensatorer lagrer elektrisk ladning i tekstilmaterialerKredit:Asociacion RUVID Forskere fra Alcoi campus ved Valencias Polytekniske Universitet (UPV) har udviklet nye enheder, der lagrer elektrisk ladning i tekstilmaterialer, som kunne bruges til, for
Nye superkondensatorer lagrer elektrisk ladning i tekstilmaterialerKredit:Asociacion RUVID Forskere fra Alcoi campus ved Valencias Polytekniske Universitet (UPV) har udviklet nye enheder, der lagrer elektrisk ladning i tekstilmaterialer, som kunne bruges til, for -
 Forebyggelse af infektion, lette helbredelse:Nye biomaterialer fra edderkoppesilkeScanning af elektronmikroskopbilleder giver et overvældende bevis på forskellen. Til venstre:En biofilm dannes på overfladen af polycaprolacton, en bionedbrydelig plast, der ofte bruges i medicin. T
Forebyggelse af infektion, lette helbredelse:Nye biomaterialer fra edderkoppesilkeScanning af elektronmikroskopbilleder giver et overvældende bevis på forskellen. Til venstre:En biofilm dannes på overfladen af polycaprolacton, en bionedbrydelig plast, der ofte bruges i medicin. T -
 Forskere opdager, hvordan overflader kan have hjulpet tidligt liv på Jorden med at begyndeSpontant dannede protoceller, som ligner balloner forankret til en overflade af et netværk af reb, visualiseres ved 3D konfokal mikroskopi. Kredit:Irep Gözen På den tidlige jord, en række spontane
Forskere opdager, hvordan overflader kan have hjulpet tidligt liv på Jorden med at begyndeSpontant dannede protoceller, som ligner balloner forankret til en overflade af et netværk af reb, visualiseres ved 3D konfokal mikroskopi. Kredit:Irep Gözen På den tidlige jord, en række spontane -
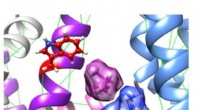 Forskere opdager molekylære mekanismer af gamle naturlægemidlerComputermodel af de to urtekomponenter, et isovalerinsyremolekyle (violet, øverst til venstre) og mallotoksin (blå, nederst til højre), optager tilstødende bindingssteder for synergistisk at aktivere
Forskere opdager molekylære mekanismer af gamle naturlægemidlerComputermodel af de to urtekomponenter, et isovalerinsyremolekyle (violet, øverst til venstre) og mallotoksin (blå, nederst til højre), optager tilstødende bindingssteder for synergistisk at aktivere


