Hvorfor har benzen et lavere kogepunkt, men meget højere smeltepunkt end toluen?
Benzen har et lavere kogepunkt (80,1 °C) end toluen (110,6 °C) på grund af dets stærkere intermolekylære kræfter. Benzenmolekyler holdes sammen af stærkere London-spredningskræfter sammenlignet med toluen. London-spredningskræfter er midlertidige attraktioner, der opstår på grund af den konstante bevægelse af elektroner i molekylet.
Den symmetriske elektronfordeling i benzen muliggør effektiv stabling af molekyler, hvilket maksimerer disse London-spredningskræfter. I modsætning hertil har toluen en methylgruppe knyttet til benzenringen, hvilket introducerer asymmetri og forstyrrer den effektive stabling. Tilstedeværelsen af methylgruppen introducerer også yderligere sterisk hindring, som yderligere hæmmer tæt pakning af toluenmolekyler. Som et resultat er de intermolekylære kræfter i benzen stærkere, hvilket fører til et lavere kogepunkt.
Højere smeltepunkt for benzen:
Benzen har et meget højere smeltepunkt (5,5 °C) sammenlignet med toluen (-95 °C) på grund af dets højere gitterenergi. I fast tilstand er benzenmolekyler arrangeret i et højt ordnet krystallinsk gitter. De stærkere London-spredningskræfter i benzen bidrager til en mere stabil og stiv gitterstruktur.
På den anden side forstyrrer tilstedeværelsen af methylgruppen i toluen den effektive stabling af molekyler i fast tilstand. Methylgruppen hindrer tæt pakning og introducerer asymmetri i gitterstrukturen, hvilket resulterer i svagere intermolekylære kræfter. Denne svagere gitterstruktur i toluen fører til et lavere smeltepunkt.
Sammenfattende kan benzens lavere kogepunkt tilskrives dets stærkere intermolekylære kræfter i flydende tilstand, mens dets højere smeltepunkt er en konsekvens af dets stærkere gitterenergi i fast tilstand.
Sidste artikelHvad er STP for ilt?
Næste artikelHvorfor er svovlforbrænding en kemisk forandring?
 Varme artikler
Varme artikler
-
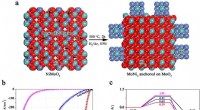 Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano
Ny metode til syntese af molekylært hydrogen sætter benchmark for platinfri elektrokatalysatorerFigur. a) Syntetisk skema af MoNi4 elektrokatalysator understøttet af MoO2 kuboiderne på nikkelskum; b) polarisationskurver for MoNi4 elektrokatalysatoren understøttet af MoO2 kuboiderne, rene Ni nano -
 Vil dit fremtidige tøj være lavet af alger?En mini-T-shirt demonstrerer de fotosyntetiske levende materialer skabt i laboratoriet af University Rochester biolog Anne S. Meyer og Delft University of Technology bionanoforsker Marie-Eve Aubin-Tam
Vil dit fremtidige tøj være lavet af alger?En mini-T-shirt demonstrerer de fotosyntetiske levende materialer skabt i laboratoriet af University Rochester biolog Anne S. Meyer og Delft University of Technology bionanoforsker Marie-Eve Aubin-Tam -
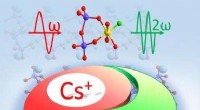 Forskning afdækker det første ikke-centrosymmetriske fluorooxosilicophosphat med Si-F-bindingerSkematisk illustration af forskningen. Kredit:Prof. LUOs gruppe Dyb-ultraviolette (UV) ikke-lineære optiske materialer spiller en afgørende rolle i en række forskellige højteknologiske videnskabel
Forskning afdækker det første ikke-centrosymmetriske fluorooxosilicophosphat med Si-F-bindingerSkematisk illustration af forskningen. Kredit:Prof. LUOs gruppe Dyb-ultraviolette (UV) ikke-lineære optiske materialer spiller en afgørende rolle i en række forskellige højteknologiske videnskabel -
 Medicin du kan bæreKredit:Swiss Federal Laboratories for Materials Science and Technology Narkotikafrigørende tekstiler kunne, for eksempel, bruges til at behandle hudsår. Empa-forskere er i øjeblikket ved at udvikl
Medicin du kan bæreKredit:Swiss Federal Laboratories for Materials Science and Technology Narkotikafrigørende tekstiler kunne, for eksempel, bruges til at behandle hudsår. Empa-forskere er i øjeblikket ved at udvikl
- Sorte mandlige pædagoger slår alarm angående mangel på mangfoldighed i P-12 klasseværelser
- Broderer elektronik i den næste generation af smarte stoffer
- Opdagelse af artefakter standser noget arbejde på marinebasen på Guam
- Førende bæredygtighedseksperter kræver en mere effektiv tilgang til at nå FN-målene
- Mauna Loa Fakta for Kids
- Hvorfor er det vigtigt for levende ting at opretholde et stabilt miljø?


