Hvis et atom har et stabilt antal elektroner, hvordan kan du vide det?
Arrangement af elektroner i energiniveauer:
- Et stabilt atom har et komplet og stabilt arrangement af elektroner i dets energiniveauer.
- De laveste energiniveauer (indre skaller) fyldes før elektroner optager højere energiniveauer (ydre skaller).
- Den yderste elektronskal, kendt som valensskallen, spiller en afgørende rolle for at bestemme et atoms stabilitet og kemiske adfærd.
Elektronkonfiguration og ædelgaskonfiguration:
- Atomer, der har en ædelgaskonfiguration, anses for at være de mest stabile. Ædelgasser har en fuld yderste elektronskal, hvilket giver dem en stabil og ikke-reaktiv natur.
- Grundstoffer i gruppe 1 (alkalimetaller) og gruppe 17 (halogener) er meget reaktive, fordi de har henholdsvis én elektron mere eller én elektron mindre end en ædelgaskonfiguration.
Oktetregel og valenselektroner:
- Oktetreglen siger, at atomer har tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af otte elektroner i det yderste energiniveau.
- Grundstoffer i anden periode (række) af det periodiske system (undtagen helium) følger oktetreglen ved at dele deres valenselektroner for at fuldende deres valensskal.
- Atomer med en komplet oktetskal, som neon (Ne), er meget stabile og generelt ikke-reaktive.
Ionisk og kovalent binding:
- Atomer kan opnå stabilitet ved at danne ioniske eller kovalente bindinger med andre atomer.
- Ionbinding opstår, når et atom overfører elektroner til et andet, hvilket resulterer i dannelsen af positive og negative ioner.
- Kovalent binding opstår, når atomer deler elektroner for at færdiggøre deres oktetskaller.
Elektronparbinding:
- Ved kovalent binding er elektroner parret og delt mellem atomer.
- Hvert elektronpar kaldes et elektronpar.
- Atomer, der har alle deres valenselektroner parret, er mere stabile end dem med uparrede elektroner.
Undtagelser og stabilitet:
- Der er undtagelser fra oktetreglen, såsom nogle overgangsmetaller og visse grundstoffer i den tredje periode og derefter.
- Nogle atomer kan have mere eller færre end otte valenselektroner og stadig være stabile på grund af deres unikke elektroniske konfigurationer eller indflydelsen af andre faktorer som molekylær geometri og bindingsvinkler.
Sammenfattende er et atoms stabilitet primært bestemt af dets elektronkonfiguration, især opnåelse af en ædelgaskonfiguration eller en stabil oktetskal. Faktorer som arrangementet af elektroner, elektronparring og at følge oktetreglen spiller afgørende roller i vurderingen af et atoms stabilitet.
 Varme artikler
Varme artikler
-
 Dalian kohærent lyskilde afslører iltproduktion fra tre-legeme fotodissociation af vandDalian Coherent Light Source afslører tre-legeme fotodissociation af vand som en vigtig præbiotisk-O2 kilde. Kredit:DICP Herkomsten af ilt på Jorden og andre solar planetariske legemer er et gru
Dalian kohærent lyskilde afslører iltproduktion fra tre-legeme fotodissociation af vandDalian Coherent Light Source afslører tre-legeme fotodissociation af vand som en vigtig præbiotisk-O2 kilde. Kredit:DICP Herkomsten af ilt på Jorden og andre solar planetariske legemer er et gru -
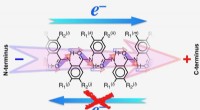 Elektroner tager et skridt fremad uden to skridt tilbageEn bioinspireret molekylær elektretdipol leder alle elektronerne mod den positive pol og forhindrer dem i at bevæge sig mod den negative pol. Kredit:Valentine Vullev Forskere ved University of Cal
Elektroner tager et skridt fremad uden to skridt tilbageEn bioinspireret molekylær elektretdipol leder alle elektronerne mod den positive pol og forhindrer dem i at bevæge sig mod den negative pol. Kredit:Valentine Vullev Forskere ved University of Cal -
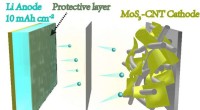 Kemikere finder en ny måde at skabe lithiummetalelektroder til batterierDette billede viser den skematiske struktur af en ny battericelle med lithiummetalelektroder udviklet ved Yale og Donghua University. Kredit:Yale University Forskere ved Yale og Donghua University
Kemikere finder en ny måde at skabe lithiummetalelektroder til batterierDette billede viser den skematiske struktur af en ny battericelle med lithiummetalelektroder udviklet ved Yale og Donghua University. Kredit:Yale University Forskere ved Yale og Donghua University -
 Moderne porøst materiale ligner XIV Century Alhambra mosaikKredit:Imdea Forskere fra Spanien og USA har syntetiseret en hidtil uset metal-organisk ramme (MOF), der indeholder en perfekt lineær brokæde, der viser en smuk lighed med en islamisk mosaik fra d
Moderne porøst materiale ligner XIV Century Alhambra mosaikKredit:Imdea Forskere fra Spanien og USA har syntetiseret en hidtil uset metal-organisk ramme (MOF), der indeholder en perfekt lineær brokæde, der viser en smuk lighed med en islamisk mosaik fra d
- Sådan kan et 'fuzzy' univers have set ud
- Ny undersøgelse viser, hvordan den antikke verden tilpassede sig klimaændringer
- Mød fremtidens landmænd:Robotter
- Slowmotion -bølger af hoppende gener i det menneskelige genom
- Hvordan bliver en tarmmikrobe et patogen?
- NASA finder dødbringende Lekimas -rester over Kina


