Er ioniseringsenergien af klor højere end fluor?
Ioniseringsenergi er den energi, der kræves for at fjerne en elektron fra et atoms yderste energiniveau. Ioniseringsenergien stiger generelt over en periode (række) i det periodiske system fra venstre mod højre og falder ned ad en gruppe (søjle). Dette skyldes, at den effektive kerneladning, som er den positive nettoladning, som den yderste elektron oplever, stiger over en periode og falder ned ad en gruppe. Jo flere protoner i kernen, jo stærkere er tiltrækningskraften mellem kernen og elektronerne, og jo mere energi kræves der for at fjerne en elektron.
Fluor er på den højre side af den anden periode i det periodiske system, mens chlor er på den højre side af den tredje periode. Derfor har fluor en højere effektiv nuklear ladning og højere ioniseringsenergi sammenlignet med klor.
Sidste artikelHvad er formelmassen for ammoniumion?
Næste artikelHvad er formlen for ammoniumion?
 Varme artikler
Varme artikler
-
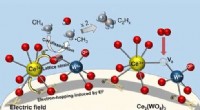 Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko
Ny, lavprisalternativ til ethylenproduktionReaktionsmekanismer for den oxidative kobling af methan (OCM) over Ce2(WO4)3-katalysatorer ved lave temperaturer i et elektrisk felt. Kredit:Waseda University Det øgede udbud og de optimerede omko -
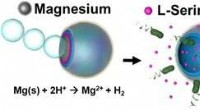 Selvkørende, løglignende mikrokøretøj kan tiltrække, fælde, og ødelægge biologiske truslerKredit:Angewandte Chemie International Edition Antibiotika er mere effektive, når de kan virke på deres mål direkte på angrebsstedet, uden fortynding. I journalen Angewandte Chemie , Amerikanske
Selvkørende, løglignende mikrokøretøj kan tiltrække, fælde, og ødelægge biologiske truslerKredit:Angewandte Chemie International Edition Antibiotika er mere effektive, når de kan virke på deres mål direkte på angrebsstedet, uden fortynding. I journalen Angewandte Chemie , Amerikanske -
 Forskere lærer mere om de første timer af et lithium-ion-batteris levetidForskere indlæser et specialdesignet lithium-ion-batteri i et sekundært ion-massespektrometer, der giver dem mulighed for at se dannelsen af fast-elektrolyt-interfasen på molekylært niveau, mens bat
Forskere lærer mere om de første timer af et lithium-ion-batteris levetidForskere indlæser et specialdesignet lithium-ion-batteri i et sekundært ion-massespektrometer, der giver dem mulighed for at se dannelsen af fast-elektrolyt-interfasen på molekylært niveau, mens bat -
 Kviksølvfjernelse gjort let i giftige miljøerKredit:Pixabay/CC0 Public Domain Kviksølvforurening er et globalt problem i vand, luft og jord i nærheden af guldminer, cement og noget metalproduktion og andre tunge industrier, der brænder foss
Kviksølvfjernelse gjort let i giftige miljøerKredit:Pixabay/CC0 Public Domain Kviksølvforurening er et globalt problem i vand, luft og jord i nærheden af guldminer, cement og noget metalproduktion og andre tunge industrier, der brænder foss


