Hvordan fremstilles brintgas i laboratoriet?
1. Reaktion af metaller med syrer:
- Zink og saltsyre: I denne metode reagerer zinkmetal med saltsyre (HCl) for at producere brintgas. Zinkgranulat tilsættes til koncentreret saltsyre i en rundbundet kolbe eller reagensglas. Reaktionen producerer bobler af brintgas, der kan opsamles ved opadgående forskydning af luft eller vand.
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
- Jern og svovlsyre: Jernmetal kan også bruges til at reagere med svovlsyre (H2SO4) for at producere brintgas. Denne reaktion er langsommere sammenlignet med reaktionen af zink og HCl.
Fe(s) + H2SO4(aq) → FeSO4(aq) + H2(g)
2. Reaktion af metalhydrider med vand:
- Metalhydrider, såsom natriumborhydrid (NaBH4) eller lithiumaluminiumhydrid (LiAlH4), reagerer med vand for at producere brintgas. Denne metode er især nyttig, når tør brintgas er påkrævet.
NaBH4(s) + H2O(l) → NaBO2(s) + 4H2(g)
- LiAlH4(s) + 4H2O(l) → LiOH(aq) + Al(OH)3(s) + 4H2(g)
3. Elektrolyse af vand:
- En anden metode til at producere brintgas er gennem elektrolyse af vand. Denne proces involverer at sende en elektrisk strøm gennem vand, hvilket får vandmolekylerne til at opdeles i brint og oxygengasser. Elektrolyse kan udføres ved hjælp af specialiseret udstyr såsom et Hofman-voltameter eller et mere sofistikeret elektrolyseapparat.
2H2O(l) → 2H2(g) + O2(g)
4. Dampreformering af kulbrinter:
- I industrielle omgivelser produceres brintgas ofte gennem dampreformeringsprocessen. I denne metode reagerer naturgas (primært sammensat af methan, CH4) med højtemperaturdamp i nærværelse af en katalysator, såsom nikkel eller platin. Denne proces omdanner metan til brint og kuldioxid.
CH4(g) + H2O(g) → CO(g) + 3H2(g)
Dette er nogle af de almindelige metoder til fremstilling af brintgas i laboratoriet. Valget af metode afhænger af faktorer som produktionens omfang, renheden af brint, der kræves, og de specifikke eksperimentelle krav.
 Varme artikler
Varme artikler
-
 Kemi baner vejen for forbedrede elektroniske materialerEt tyndt lag indiumnitrid på siliciumcarbid, skabt ved hjælp af molekylet udviklet af forskere ved Linköpings universitet, Sverige. Kredit:Magnus Johansson/Linköpings universitet Indiumnitrid er e
Kemi baner vejen for forbedrede elektroniske materialerEt tyndt lag indiumnitrid på siliciumcarbid, skabt ved hjælp af molekylet udviklet af forskere ved Linköpings universitet, Sverige. Kredit:Magnus Johansson/Linköpings universitet Indiumnitrid er e -
 Meget effektiv, langtidsholdbar elektrokatalysator for at øge produktionen af brintbrændstofKrystalstruktur af iltrig metallegering på overfladen (øverst til venstre). Ilt og brint dannes under en vandelektrolysereaktion (øverst til højre). Den designede katalysator udviser den bedste oxygen
Meget effektiv, langtidsholdbar elektrokatalysator for at øge produktionen af brintbrændstofKrystalstruktur af iltrig metallegering på overfladen (øverst til venstre). Ilt og brint dannes under en vandelektrolysereaktion (øverst til højre). Den designede katalysator udviser den bedste oxygen -
 På ny bekræfter værdien af internationale samarbejderKredit:CC0 Public Domain Videnskabeligt samarbejde over hele kloden er en vigtig del af moderne forskning. Imidlertid, politiske og økonomiske stridigheder mellem regeringer, såsom de nuværende sp
På ny bekræfter værdien af internationale samarbejderKredit:CC0 Public Domain Videnskabeligt samarbejde over hele kloden er en vigtig del af moderne forskning. Imidlertid, politiske og økonomiske stridigheder mellem regeringer, såsom de nuværende sp -
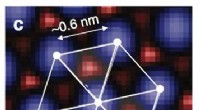 Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
Scanning af overfladen af lithiumtitanatDen tredobbelte symmetri, der er angivet her, afslører spinelkrystalstrukturen. Kredit:Taro Hitosugi, Naturkommunikation Forskere ved Tokyo Institute of Technology, Tohoku University og Universi
- AI-radarsystem, der kan spotte miniaturedroner 3 kilometer væk
- Liste over mineraler fundet under havet Bed
- Flydende parker lavet af plastikaffald kan forene samfund for at tackle forurening
- Teamopfindelse kan hjælpe med at beskytte astronauter mod stråling i rummet
- Små murstensprængende muskler til miniaturerobotter er hentet fra træ
- Canadiske iskerneprøver viser, at holocæne temperaturer var højere end i dag


