Et molekyle, der har let negative og positive ender med hensyn til forandring?
Her er hvorfor:
* Polaritet: Dette henviser til den ujævne fordeling af elektrondensitet inden for et molekyle.
* Elektronegativitet: Elektronegativitet er et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding. Når to atomer med forskellige elektronegativiteter binder, tilbringer de delte elektroner mere tid tættere på atomet med den højere elektronegativitet.
* dipolmoment: I et polært molekyle skaber den ujævne fordeling af elektroner en adskillelse af ladning, hvilket resulterer i et dipolmoment . Den ene ende af molekylet har en lidt negativ ladning (Δ-), og den anden ende har en lidt positiv ladning (Δ+).
Eksempel:
* vand (H₂O): Oxygen er mere elektronegativ end brint. Oxygenatomet tiltrækker de delte elektroner stærkere og skaber en delvis negativ ladning på ilt og en delvis positiv ladning på hydrogenatomerne. Dette gør vand til et polært molekyle.
Betydningen af polære molekyler:
Polære molekyler spiller afgørende roller i mange kemiske og biologiske processer, herunder:
* opløselighed: Polære molekyler opløses godt i andre polære opløsningsmidler, såsom vand.
* Intermolekylære kræfter: Dipolmomentet giver mulighed for stærkere intermolekylære kræfter (hydrogenbindinger, dipol-dipol-interaktioner) mellem polære molekyler.
* Biologiske funktioner: Polære molekyler er vigtige for mange biologiske funktioner, som transport af næringsstoffer, cellulær kommunikation og enzymatiske reaktioner.
Sidste artikelHvilket næringsstof er det nødvendigt i store mængder?
Næste artikelHvor mange protoner er der i et nitrogrenatom?
 Varme artikler
Varme artikler
-
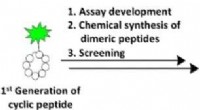 Screening for makrocykliske peptiderKredit:Ganga B. Vamisetti et al. Udviklingen af et fluorescens-baseret kompetitivt assay muliggjorde opdagelsen af dimeriske cykliske peptidmodulatorer af ubiquitinkæder, Angewandte Chemie Intern
Screening for makrocykliske peptiderKredit:Ganga B. Vamisetti et al. Udviklingen af et fluorescens-baseret kompetitivt assay muliggjorde opdagelsen af dimeriske cykliske peptidmodulatorer af ubiquitinkæder, Angewandte Chemie Intern -
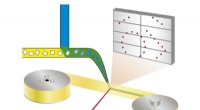 Ny metode muliggør automatiseret hurtig undersøgelse af enzymatiske processerPrincip for bland-og-diffus seriel synkrotronkrystallografi:Proteinkrystaller blandes med en opløsning af en lægemiddelkandidat og røntgenstråles på et bånd, der løber gennem røntgenstrålen. Kredit:Be
Ny metode muliggør automatiseret hurtig undersøgelse af enzymatiske processerPrincip for bland-og-diffus seriel synkrotronkrystallografi:Proteinkrystaller blandes med en opløsning af en lægemiddelkandidat og røntgenstråles på et bånd, der løber gennem røntgenstrålen. Kredit:Be -
 Forskere udvikler mere effektivt katalytisk materiale til brændselscelle applikationerDette billede i høj opløsning viser fordelingen af platin og zinkatomer i en PtZn intermetallisk nanopartikel. Kredit:Ames Laboratory, Det amerikanske energiministerium Forskere ved Ames Laborat
Forskere udvikler mere effektivt katalytisk materiale til brændselscelle applikationerDette billede i høj opløsning viser fordelingen af platin og zinkatomer i en PtZn intermetallisk nanopartikel. Kredit:Ames Laboratory, Det amerikanske energiministerium Forskere ved Ames Laborat -
 Et fast opløsningsmiddel til unikke materialerSyntese af nyt materiale ved hjælp af et fast opløsningsmiddel. Et substrat dækket med et system af ensartet fordelte ankre nedsænkes i en opløsning indeholdende de ønskede atomer eller molekyler, som
Et fast opløsningsmiddel til unikke materialerSyntese af nyt materiale ved hjælp af et fast opløsningsmiddel. Et substrat dækket med et system af ensartet fordelte ankre nedsænkes i en opløsning indeholdende de ønskede atomer eller molekyler, som
- Skiftende ledningstilstand - et skridt mod topologiske transistorer
- Fremstilling af mekanisk hud
- Opfindelsen af gelé kan helbrede sig selv som menneskelig hud
- Garanteret indkomst øger beskæftigelsen, forbedrer økonomisk og fysisk sundhed
- Quadruple fusion imaging via transparent ultralydstransducer
- Hvad er formlen for svovlsyre?


