Ny metode muliggør automatiseret hurtig undersøgelse af enzymatiske processer
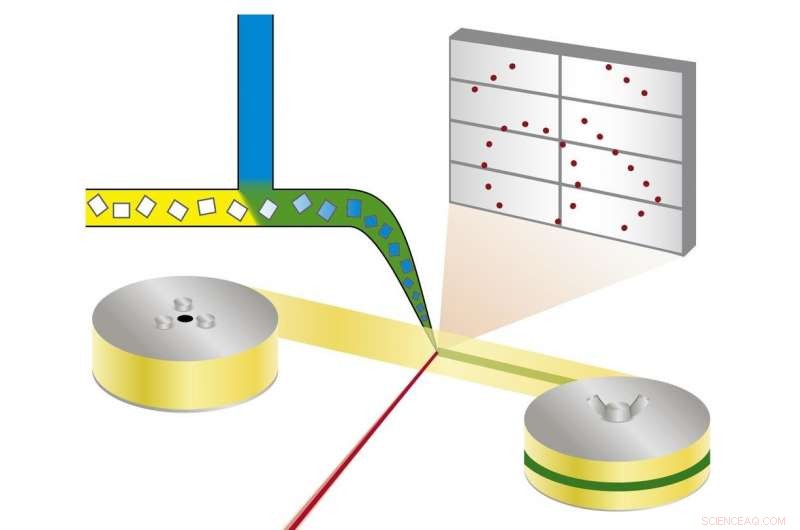
Princip for bland-og-diffus seriel synkrotronkrystallografi:Proteinkrystaller blandes med en opløsning af en lægemiddelkandidat og røntgenstråles på et bånd, der løber gennem røntgenstrålen. Kredit:Beyerlein et al., IUCrJ
Forskere ved DESY har udviklet en ny metode, der muliggør automatisk og hurtig screening af lovende lægemiddelkandidater. Denne nye teknik, kaldet bland-og-diffus seriel synkrotronkrystallografi, kan afbilde interaktionen mellem potentielle lægemiddelmål med lægemiddelkandidater eller andre molekyler. Konceptet har potentialet til at tage struktur og fragmentbaseret lægemiddeldesign til et nyt niveau, som forskerne skriver i Journal of the International Union of Crystallography ( IUCrJ ).
Mange proteiner i kroppen er potentielle lægemiddelmål. Farmaceutiske molekyler med den korrekte form kan binde sig til disse proteiner og aktivere eller deaktivere deres funktion. For eksempel, at bekæmpe visse former for leukæmi, kræftlægemidlet Imatinib hæmmer en overaktiv variant af enzymet tyrosinkinase, et protein, der er ansvarligt for at aktivere mange andre proteiner. Imatinib blokerer det aktive sted for denne tyrosinkinase. For at opnå dette, lægemiddelmolekylet skal passe præcist ind i det aktive sted som en nøgle i en lås. Baseret på viden om den rumlige struktur af enzymmålet, Imatinib blev skræddersyet til dette formål.
"Denne strategi kaldes strukturbaseret lægemiddeldesign og bruges i dag som en standardmetode til udvikling af lægemidler, "forklarer første forfatter Kenneth Beyerlein fra Center for Free-Electron Laser Science (CFEL), et samarbejde mellem DESY, universitetet i Hamburg og det tyske Max Planck Society. "Imidlertid, i virkeligheden er målretning mod proteiner meget mere kompleks end at montere en nøgle i en lås. Derfor, mange potentielle farmaceutiske molekyler eller fragmenter af sådanne molekyler skal testes, som normalt er en lang og kompliceret procedure. "Desuden både biologer og farmakologer er interesserede i den præcise funktion af naturlige midler, der binder til proteiner, for bedre at forstå livets maskineri.
Systemet udviklet af teamet omkring Beyerlein og hans DESY-kollega Dominik Oberthür, også fra CFEL, tilbyder en ny måde at forfølge dette mål på:Den blander mikrokrystallinske proteiner med specifikke molekyler kaldet ligander, der kan være lægemiddelkandidater eller naturlige midler, lige før de sonderer krystallerne med røntgenstråler for at afsløre den detaljerede rumlige struktur af det resulterende protein-ligandkompleks eller fravær af et sådant kompleks, hvis en potentiel ligand ikke binder til proteinet.
At analysere den rumlige struktur af et protein, forskere bruger ofte røntgenkrystallografi. Til denne teknik, en krystal skal først dyrkes fra proteinet. Forskere tager derefter røntgenbilleder fra alle sider af krystallen, der skal afkøles til ultralave temperaturer for at reducere skader fra den intense stråling. Røntgenstrålerne producerer et karakteristisk diffraktionsmønster, hvorfra den indre struktur af krystallen og dermed proteinets rumlige struktur kan beregnes. For at undersøge et protein med en ligand, en ny krystal skal dyrkes fra en protein- og ligandopløsning, eller krystallen skal gennemblødes med liganden. Selv med brugen af robotter til at automatisere alle trin i denne proces, behovet for at montere individuelle krystaller for hvert nyt datasæt er blevet det hastighedsbegrænsende trin i screeningen af store sammensatte biblioteker.
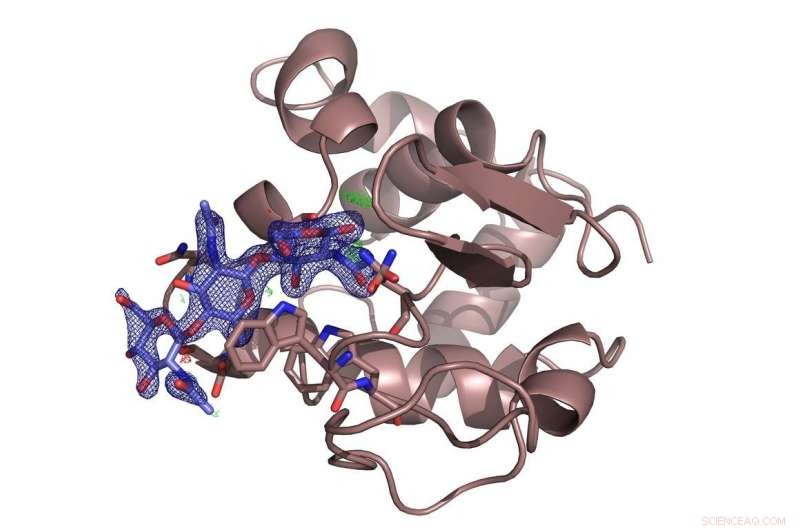
Enzymet lysozym (brunt) med det hæmmende sukker chitotriose (blåt) bundet til det. Undersøgelsen afgjorde en strid om det foretrukne bindingssted for sukkermolekylet. Kredit:DESY, Dominik Oberthür
Den nye teknik følger en anden tilgang. "Vi bruger mikrokrystaller, som har to fordele:De er normalt meget lettere at producere end store krystaller, og de er små nok til at et potentielt lægemiddel i en opløsning kan diffundere gennem krystallen og binde til alle proteinmolekyler inden for få millisekunder, " forklarer Oberthür. Systemet udviklet af teamet af Oberthür og Beyerlein dispenserer en strøm af mikrokrystaller i en bærervæske på et tyndt bånd. Som et transportbånd, båndet bærer krystallerne gennem røntgenstrålen, der er skåret i korte blink af en roterende rullegardin. I stedet for at rotere en stor krystal i røntgenstrålen, mange mikrokrystaller i tilfældig orientering udsættes således for røntgenstråler på en seriel måde, og diffraktionsmønstrene fra hvert skud kombineres senere til et komplet datasæt, efter konceptet seriel krystallografi, der først blev udviklet ved fri-elektron røntgenlasere (XFEL'er).
Gennem en anden ventil i systemet, en opløsning af en lægemiddelkandidat eller naturlig ligand tilsættes. Punktet, hvor de to væsker blandes, kan justeres for at skabe en defineret forsinkelse, før strukturen undersøges. Denne opsætning kræver ikke kryokøling af krystaller, derfor kan protein-lægemiddel-interaktionen observeres ved fysiologiske temperaturer, eller enhver anden ønsket temperatur. Denne måde, selv bindingsdynamikken kan undersøges. "Vi kan sprede kemikalier ind i proteinkrystallerne i en fart og se bindingen ske, "forklarer Oberthür." Du behøver ikke at finde nye vækstbetingelser for hver hæmmer, og du behøver ikke at udskifte krystallerne manuelt, hele processen kan automatiseres."
Holdet testede det nye system på DESYs højglans røntgenkilde PETRA III med det velkendte protein lysozym og et sukkermolekyle, chitotriose, der hæmmer enzymet. De lysozymmikrokrystaller, der blev anvendt her, var kun omkring seks til otte mikrometer i diameter. Opstillingen ved målestation P11 afslørede den rumlige struktur af den indblandede inhibitor bundet til lysozym i detaljer. Og selvom strukturen af lysozym var den første enzymstruktur, der blev afsløret ved røntgenkrystallografi for 50 år siden, den nye metode kunne stadig afsløre nye detaljer om bindingsmåden for chitotriose til lysozym, afgøre en strid om det foretrukne bindingssted for sukkermolekylet.
Selv om principbeviset stadig krævede noget tid, rutine og yderligere fremskridt inden for detektor- og røntgenteknologi vil fremskynde proceduren betydeligt. Også, ved at bruge hele røntgenstrålespektret fra synkrotronlyskilden i stedet for kun en enkelt "farve" fra den, kan skubbe eksponeringstiden for individuelle diffraktionsbilleder ned til 100 picosekunder, eller 0,1 milliardtedele af et sekund. Kun 50 af disse billeder er tilstrækkelige til at bestemme strukturen, som det for nylig blev vist.
"Vi er ved at udvikle måder at løse strukturen af bundne proteiner til at opdage lægemidler med høj kapacitet, " forklarede Beyerlein. Da synkrotronlyskilder er mere tilgængelige end røntgenlasere, forskerne forestiller sig at bruge denne metode til rutinemæssig screening gennem biblioteker af potentielle inhibitorer og lægemiddelfragmenter. "At gøre dette automatisk og meget hurtigere end med konventionelle tilgange ville være et stort skridt fremad i strukturbaseret lægemiddeldesign, " siger Beyerlein.
 Varme artikler
Varme artikler
-
 Ny metode til at forbinde præfabrikerede betonbjælker og søjlerAdjunkt Mostafa Tazarv fra Institut for Bygge- og Miljøteknik fører tilsyn med test af en ny metode til at forbinde præfabrikerede betonbjælker og søjler, der gør det muligt at reparere bygninger efte
Ny metode til at forbinde præfabrikerede betonbjælker og søjlerAdjunkt Mostafa Tazarv fra Institut for Bygge- og Miljøteknik fører tilsyn med test af en ny metode til at forbinde præfabrikerede betonbjælker og søjler, der gør det muligt at reparere bygninger efte -
 Får mac og ost til MarsWSU kandidatstuderende Juhi Patel, en forfatter på mac og ost papir, sætter pakker med lilla kartofler i en inkubator, hvilket fremskynder ændringerne i fødevarekvaliteten med en ensartet hastighed. K
Får mac og ost til MarsWSU kandidatstuderende Juhi Patel, en forfatter på mac og ost papir, sætter pakker med lilla kartofler i en inkubator, hvilket fremskynder ændringerne i fødevarekvaliteten med en ensartet hastighed. K -
 Ny katalysator kunne muliggøre bedre lithium-svovl-batterier, power næste generations elektronikKredit:CC0 Public Domain I hjertet af det meste af elektronik i dag er genopladelige lithium-ion-batterier (LIBer). Men deres energilagringskapacitet er ikke nok til storskala energilagringssystem
Ny katalysator kunne muliggøre bedre lithium-svovl-batterier, power næste generations elektronikKredit:CC0 Public Domain I hjertet af det meste af elektronik i dag er genopladelige lithium-ion-batterier (LIBer). Men deres energilagringskapacitet er ikke nok til storskala energilagringssystem -
 Er amorfe faste stoffer elastiske eller plastiske?Til venstre:Stabilitets-reversibilitetskort over amorfe faste stoffer i hårde kugler, repræsenteret med hensyn til volumen og forskydningsbelastninger. Til højre:Typiske stress-strain-kurver, som vise
Er amorfe faste stoffer elastiske eller plastiske?Til venstre:Stabilitets-reversibilitetskort over amorfe faste stoffer i hårde kugler, repræsenteret med hensyn til volumen og forskydningsbelastninger. Til højre:Typiske stress-strain-kurver, som vise
- Mytesprængende antikke Rom – førte alle veje faktisk dertil?
- Ny lov kan tvinge små virksomheder til at afsløre datapraksis
- Guatemala har levet i skyggen af vulkaner i århundreder
- Hvide amerikanere er mindre opmærksomme på sorte jævnaldrende, siger en ny undersøgelse
- Dobbelt-ophidsede elektroner når nye energitilstande
- Ulemperne ved lineær programmering


