Har det røde lys fra glødende neongas kun en frekvens eller en blanding af frekvenser?
* atomstruktur: Atomer har elektroner, der kan hoppe mellem energiniveauet. Når en elektron falder fra et højere til et lavere niveau, frigiver den energi i form af lys. Den specifikke energiforskel mellem niveauerne bestemmer frekvensen (og farve) af det udsendte lys.
* Neons energiniveau: Neon har flere energiniveauer, hvilket betyder, at elektroner kan skifte mellem forskellige par niveauer, hvilket resulterer i forskellige lysfrekvenser.
* dominerende rød: Mens neon udsender et spektrum af farver, er det mest intense og mærkbare lys i den røde del af spektret, hvilket giver neonskilt deres karakteristiske farvetone.
Selvom det røde lys fra et neonskilt forekommer ensartet, er det faktisk sammensat af en række frekvenser, hvor den røde frekvens er den mest fremtrædende.
 Varme artikler
Varme artikler
-
 Genbrug giver brugt nukleart brændsel nyt formålTil genbrug, brugt nukleart brændsel føres ind i et kemisk behandlingssystem, der adskiller aktinidelementer, der kan genanvendes som blandet oxidbrændsel for at producere mere elektrisk strøm. Hos PN
Genbrug giver brugt nukleart brændsel nyt formålTil genbrug, brugt nukleart brændsel føres ind i et kemisk behandlingssystem, der adskiller aktinidelementer, der kan genanvendes som blandet oxidbrændsel for at producere mere elektrisk strøm. Hos PN -
 Løsning af strukturen af ATP -syntaseStruktur af den monomere gær -ATP -syntase, vist som en overfladerepræsentation, som bestemt ved kryo-elektronmikroskopi. Kredit:Rosalind Franklin University Et team af forskere ledet af Rosalind
Løsning af strukturen af ATP -syntaseStruktur af den monomere gær -ATP -syntase, vist som en overfladerepræsentation, som bestemt ved kryo-elektronmikroskopi. Kredit:Rosalind Franklin University Et team af forskere ledet af Rosalind -
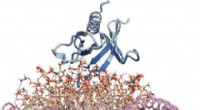 Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove
Indsigt på atomniveau opnået for et vigtigt lipidbindende protein impliceret i kræftNanodisk erstatning cellemembran:Protein er blåt, lipider er hvede, og de to spiralformede lipoproteiner, der holder lipid-nanoskiven sammen, er lyserøde. Kredit:Sanford Burnham Prebys Medical Discove -
 Brug af neutroner og røntgenstråler til at analysere ældningen af lithiumbatterierRøntgentomografien viser brud (sort) i områderne af elektriske kontakter (hvide). Kredit:T.Arlt, I. Manke/HZB, R. Ziesche/UCL Lithium-batterier driver smartphones, bærbare computere, og elektriske
Brug af neutroner og røntgenstråler til at analysere ældningen af lithiumbatterierRøntgentomografien viser brud (sort) i områderne af elektriske kontakter (hvide). Kredit:T.Arlt, I. Manke/HZB, R. Ziesche/UCL Lithium-batterier driver smartphones, bærbare computere, og elektriske
- Pavlovs klassiske konditionering inspirerer materialeforskere
- Hvor får celler primært denne energi?
- Klimaforandringernes positive sider? Forskning viser landbrug, økonomiske muligheder
- Hvad er pH-tallet for natriumhydroxid?
- Hvad er breddegrad og længdegrad i Middelhavet?
- Magnetoelektrisk materiale viser løfte som hukommelse for elektronik


